和
是正处于临床试验阶段的小分子抗癌药物,结构如下:

关于
和
的叙述,错误的是
| A. | 都能与 溶液反应,原因不完全相同 |
| B. | 都能与溴水反应,原因不完全相同 |
| C. | 都不能发生消去反应,原因相同 |
| D. | 遇 溶液都显色,原因相同 |
在某一溶液中可能含有下列几种离子:K+、Fe3+、Ag+、Ba2+、AlO2—、CO32—、SO32—、SO42—。某该溶液进行有关实验,实验步骤及结果如下:
①向溶液中加入过量稀盐酸,得到气体甲和溶液甲;
②向溶液甲中加入过量NH4HCO3溶液,得到白色沉淀乙、气体乙和溶液乙;
③向溶液乙中加入过量Ba(OH)2溶液并加热,得到白色沉淀丙、气体丙和溶液丙。
④检验气体甲、气体乙、气体丙,都只含有一种成分,而且各不相同。
下列说法正确的是
| A.气体甲可能为CO2或者SO2 |
| B.沉淀丙中一定含有BaCO3,可能含有BaSO4 |
| C.该溶液中肯定存在的离子有K+、AlO2—、SO32—、SO42— |
| D.只根据实验①能得出溶液中一定没有Fe3+、Ag+、Ba2+,K+是否存在无法确定。 |
下列气体发生装置,当加入适当的块状固体和液体时不具有随开随关功能的是
实验室将I2溶于KI溶液中,配制浓度较大的碘水,主要是因为发生了反应:I2(aq)+I-(aq) I3- (aq)。上述平衡体系中,I3-的物质的量浓度c(I3-)与温度T的关系如图所示(曲线上的任何一点都表示平衡状态)。下列说法不正确的是
I3- (aq)。上述平衡体系中,I3-的物质的量浓度c(I3-)与温度T的关系如图所示(曲线上的任何一点都表示平衡状态)。下列说法不正确的是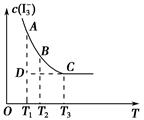
| A.该反应的正反应是吸热反应 |
| B.A点与C点的化学反应速率vA<vC |
| C.反应进行到D点时,v(正)>v(逆) |
| D.A点与B点相比,B点的c(I-)大 |
为了检验新型镍催化剂在不同温度下对苯催化加氢的影响。其他条件相同,定时取样分析成分:
| 温度/℃ |
85 |
90 |
95 |
100 |
200 |
280 |
300 |
320 |
340 |
| 苯(mmol) |
96.05 |
91.30 |
91.55 |
80.85 |
10 |
23.35 |
36.90 |
55.99 |
72.37 |
| 环己烷 (mmol) |
3.95 |
8.7 |
8.45 |
19.15 |
90 |
76.65 |
63.10 |
44.01 |
27.63 |
(采用微型反应装置,压强为0.78 MPa,氢、苯物质的量之比为6.5∶1)
下列说法错误的是
A.随着反应温度的升高,苯的转化率先升高后降低
B.通过改变温度或压强不能使氢气和苯的转化率相同
C.调控压强与氢、苯物质的量之比可能有利于提高苯的转化率
D.当温度超过280 ℃,苯的转化率迅速下降,可能是因为该反应为吸热的可逆反应