工业上常用电解硫酸钠溶液联合生产硫酸和烧碱溶液的装置如图所示,其中阴极和阳极均为惰性电极.测得同温同压下,气体甲与气体乙的体积比约为1:2,以下说法正确的是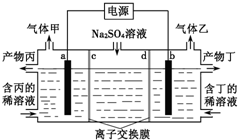
| A.a极与电源的负极相连 |
| B.产物丙为硫酸溶液 |
| C.离子交换膜d为阴离子交换膜 |
| D.a电极反应式:2H2O+2e-=H2↑+2OH- |
下列过程或现象与盐类水解无关的是()
| A.纯碱溶液去油污 |
| B.加热稀醋酸溶液其pH 稍有减小 |
| C.小苏打溶液与AlCl3溶液混合产生气体和沉淀 |
| D.浓的硫化钠溶液有臭味 |
下列说法正确的是 ( )
| A.强电解质溶液一定比弱电解质溶液的导电性强 |
| B.强电解质的稀溶液中不存在溶质分子 |
| C.强电解质都是离子化合物,而弱电解质都是共价化合物 |
| D.不同的弱电解质只要物质的量的浓度相同,电离程度也相同 |
纯净的NaCl并不潮解,但家庭所用的食盐因含有MgCl2杂质而易于潮解。为得到纯净的氯化钠,有人设计这样一个实验:把买来的食盐放入纯NaCl的饱和溶液中一段时间,过滤即得纯净的NaCl固体。对此有下列说法,其中正确的是 ( )
| A.食盐颗粒大一些有利于提纯 |
| B.设计实验的根据是MgCl2比NaCl易溶于水 |
| C.设计实验的根据是NaCl的溶解平衡 |
| D.在整个过程中,NaCl的物质的量浓度会变大 |
某温度下,H2(g)+CO2(g) H2O(g)+CO(g)的平衡常数K=2.25。该温度下在甲、乙、丙三个恒容密闭容器中,投入H2(g)和CO2(g),其起始浓度如右表所示。
H2O(g)+CO(g)的平衡常数K=2.25。该温度下在甲、乙、丙三个恒容密闭容器中,投入H2(g)和CO2(g),其起始浓度如右表所示。
| 起始浓度 |
甲 |
乙 |
丙 |
| c(H2)/mol/L |
0.010 |
0.020 |
0.020 |
| c(CO2)/mol/L |
0.010 |
0.010 |
0.020 |
下列判断不正确的是()
| A.反应开始时,反应速率:甲<乙<丙 |
| B.平衡时,甲中和丙中H2的转化率均是60% |
| C.平衡时,c(CO2)丙=2c(CO2)甲 |
| D.平衡时,乙中CO2的体积分数大于60% |
下列对化学平衡移动的分析中,不正确的是()
①已达平衡的反应C(s)+H2O(g) CO(g)+H2(g),当增加反应物物质的量时,平衡一定向正反应方向移动
CO(g)+H2(g),当增加反应物物质的量时,平衡一定向正反应方向移动
②已达平衡的反应N2(g)+3H2(g) 2NH3(g),当增大N2的浓度时,平衡向正反应方向移动,N2的转化率一定升高
2NH3(g),当增大N2的浓度时,平衡向正反应方向移动,N2的转化率一定升高
③有气体参加的反应平衡时,若减小反应器容积时,平衡一定向气体体积增大的方向移动
④有气体参加的反应达平衡时,在恒压反应器中充入稀有气体,平衡一定不移动
| A.①④ | B.①②③ | C.②③④ | D.①②③④ |