某溶液中可能含有下列6种离子中的某几种:Cl-、SO42-、CO32-、NH4+、Na+、K+。为确认溶液组成进行如下实验:(1)200mL上述溶液,加入足量BaCI2溶液,反应后将沉淀过滤、洗涤、干燥,得沉淀4.30g,向沉淀中加入过量的盐酸,有2.33g沉淀不溶.(2)向(1)的滤液中加入足量的NaOH溶液,加热,产生能促使湿润红色石蕊试纸变蓝的气体1.12L(已换算成标准状况,假定产生的气体全部逸出).由此可以得出关于原溶液组成的正确结论是
| A.c(CO32-)=0.01mol•L-1,c(NH4+)>c(SO42-) |
| B.如果上述6种离子都存在,则c(Cl-)>c(SO42-) |
| C.一定存在SO42-、CO32-、NH4+,可能存在Cl-、Na+、K+ |
| D.一定存在SO42-、CO32-、NH4+、Cl-,一定不存在Na+、k+ |
英国媒体05年4月15日报道,高露洁牙膏中含有的消毒剂三氯生,遇含氯自来水能生成哥罗芳(三氯甲烷),哥罗芳能导致肝病甚至导致癌症。已知三氯生的结构简式如下:有关说法不正确的是 ( )
| A.三氯生的分子式为:C12H7Cl3O2 |
B.哥罗芳不存在同分异构体 |
| C.三氯生能与氢氧化钠溶液反应 |
| D.三氯生易溶于水 |
某有机物能使溴水褪色,也能在一定条件下水解生成两种有机物,还能发生加聚反应生成高分子化合物。现有: ①—COOCH3②—OH ③—CH3 ④—CHO ⑤—CH CH— ⑥—COOH ⑦—Br。则此有机物可同时含有的基团是 ( )
CH— ⑥—COOH ⑦—Br。则此有机物可同时含有的基团是 ( )
| A.④⑦ | B.②⑥ | C.①⑤ | D.④⑤ |
不饱和脂肪酸是常见的保健品,DHA(分子式为C22H32O2)是近年来倍受关注的一元不饱和高级脂肪酸(分子中只含有双键),它对大脑细胞的生长发 育具有重要意义,许多海洋生物食 品含有丰富的DHA。则在一个DHA分子中含有的碳碳双键数为 ()
A.6个 B.5个 C.4个 D.7个
某饱和一元醇C7H15OH发生消去反应,只得到两种单烯烃,则该醇的结构简式可能是下列中的( )
A.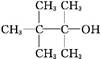 |
B.CH3(CH2)5CH2OH |
C. |
D.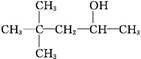 |
下列实验能成功的是 ( )
| A.将乙酸和乙醇混合加热制乙酸乙酯 |
| B.用CuSO4溶液和过量NaOH溶液混合,然后加入几滴乙醛,加热 |
| C.CH3CH2Br中滴加AgNO3溶液观察是否有浅黄色沉淀,判断卤代烃的类型 |
| D.苯和浓溴水反应制溴苯 |