I、在理论上不能用于设计原电池的化学反应是
| A.CH4(g)+2 O2(g)=" C" O2(g)+2 H2O(1) △H <0 |
| B.Ba(OH)2·8H2O(s)+2NH4Cl(s)= BaCl2(aq)+2NH3·H2O(aq)+8H2O(1) △H >0 |
| C.4Al(s)+ 6H2O(1)+ 3O2(g)==4Al(OH)3(s) △H <0 |
| D.Zn(s)+2MnO2(s)+2H2O(1)= 2MnOOH(s)+Zn(OH)2(s) △H <0 |
若你认为A可以设计成原电池,创造碱性环境,请写出负极的电极反应式为 (若你认为不能此空不填)。
II、北京奥运会“祥云”火炬燃料是丙烷(C3H8),亚特兰大奥运会火炬燃料是丙烯(C3H6)
(1)丙烷脱氢可得丙烯。
已知:C3H8(g) = CH4(g)+HC CH(g)+H2(g) △H1=156.6 kJ·mol-1
CH(g)+H2(g) △H1=156.6 kJ·mol-1
CH3CH CH2(g) = CH4(g)+HC
CH2(g) = CH4(g)+HC CH(g ) △H2=32.4 kJ·mol-1
CH(g ) △H2=32.4 kJ·mol-1
则相同条件下,反应C3H8(g)= CH3CH CH2(g)+H2(g)的△H= kJ·mol-1。
CH2(g)+H2(g)的△H= kJ·mol-1。
(2)以丙烷为燃料制作燃料电池,电池的正极通入O2和CO2,负极通入丙烷,电解质是熔融碳酸盐。电池反应方程式为 ;放电时CO32-移向电池的 (填“正”或“负”)极。负极的电极反应式为
4.8gO2和0.2molCO2,质量之比是,在同温同压下的体积之比是.相同物质的量的SO2和SO3,所含分子的数目之比为,所含O原子的物质的量之比为.
选择下列实验方法分离物质,将分离方法的序号填在横线上.
| A.萃取分液法 | B.加热分解法 | C.结晶法 | D.分液法 E.蒸馏法 F.过滤法 |
(1)分离饱和食盐水与沙子的混合物.
(2)从硝酸钾和氯化钠的混合溶液中获得硝酸钾.
(3)分离水和汽油的混合物.
(4)分离四氯化碳(沸点为76.75℃)和甲苯(沸点为110.6℃)的混合物.
(5)从碘的水溶液里提取碘.
一密封体系中发生下列反应:N2 +3H2 2NH3 +Q,下图是某一时间段中反应速率与反应进程的曲线关系图:
2NH3 +Q,下图是某一时间段中反应速率与反应进程的曲线关系图: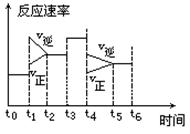
回答下列问题:
(1)处于平衡状态的时间段是______.
(2)t1、t3、t4时刻体系中分别是什么条件发生了变化?
、、
(3)下列各时间段时,氨的百分含量最高的是______.
| A.t0~t1 | B.t2~t3 | C.t3~t4 | D.t5~t6 |
对可逆反应aA(g)+bB(g) cC(g)+dD(g)达到平衡时,各物质的物质的量浓度满足以下关系:
cC(g)+dD(g)达到平衡时,各物质的物质的量浓度满足以下关系: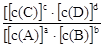 =K(为一常数),K称为化学平衡常数,其反应的K值只与温度有关。现有反应:CO(g)+H2O(g)
=K(为一常数),K称为化学平衡常数,其反应的K值只与温度有关。现有反应:CO(g)+H2O(g) CO2(g)+H2(g)+Q。在850℃时,K=1。
CO2(g)+H2(g)+Q。在850℃时,K=1。
(1)若升高温度到950℃时,达到平衡时K1(填“大于”“小于”或“等于”)。
(2)850℃时,若向一容积可变的密闭容器中同时充入1.0 mol CO,3.0 mol H2O,1.0 mol CO2和x mol H2,则:
①当x=5.0时,上述平衡向(填“正反应”或“逆反应”)方向移动。
②若要使上述反应开始时向正反应方向进行,则x应满足的条件是。
(3)在850℃时,若设x=5.0和x=6.0,其他物质的投料不变,当上述反应达到平衡后,测得H2的体积分数分别为a%、b%,则ab(填“大于”“小于”或“等于”)。
Ag2O2是银锌碱性电池的正极活性物质,可通过下列方法制备:在KOH加入适量AgNO3溶液,生成Ag2O沉淀,保持反应温度为80,边搅拌边将一定量K2S2O8溶液缓慢加到上述混合物中,反应完全后,过滤、洗涤、真空干燥得到固体样品.反应方程式为
2AgNO3+4KOH+K2S2O8 Ag2O2↓+2KNO3+2K2SO4+2H2O
Ag2O2↓+2KNO3+2K2SO4+2H2O
回答下列问题:
(1)上述制备过程中,检验洗剂是否完全的方法是
(2)银锌碱性电池的电解质溶液为KOH溶液,电池放电时正极的Ag2O2转化为Ag,负极的Zn转化为K2Zn(OH)4,写出该电池反应方程式:.
(3)准确称取上述制备的样品(设仅含Ag2O2和Ag2O) 2.558g,在一定的条件下完全分解为Ag 和O2,得到224.0mLO2(标准状况下).计算样品中Ag2O2的质量分数(计算结果精确到小数点后两位).