I、 肼(N2H4)又称联氨,在常温下是一种可燃性的液体,可用作火箭燃料。已知在101kPa时,1gN2H4在氧气中完全燃烧生成氮气和H2O,放出19.5kJ热量(25℃时),表示N2H4燃烧的热化学方程式是_________________________
II、在火箭推进器中装有强还原剂肼(N2H4)和强氧化剂(H2O2),当它们混合时,即产生大量的N2和水蒸气,并放出大量热。已知0.4mol液态肼和足量H2O2反应,生成氮气和液态水,放出327.05kJ的热量。
(1)写出该反应的热化学方程式_______________。
(2)已知H2O(l)====H2O(g);△H=+44kJ·mol-1,则16 g液态肼燃烧生成氮气和水蒸气时,放出的热量是______________kJ。
(3)已知N2(g)+2O2(g)="===2" NO2(g);△H=+67.7 kJ·mol-1, N2H4(g)+O2(g)="==" N2(g)+2H2O (g);△H="-534" kJ·mol-1,根据盖斯定律写出肼与NO2完全反应生成氮气和气态水的热化学方程式__________________。
III、肼-空气燃料电池是一种碱性燃料电池,电解质溶液是20%~30%的KOH溶液。肼-空气燃料电池放电时:正极的电极反应式:_________________________;
负极的电极反应式:_______________________ __。
兔耳草醛是食品与化妆品工业中的香料添加剂。工业上可通过有机化工原料A制得,其合成路线如下图所示:
A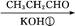 B
B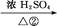 C
C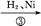 D
D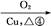
 (兔耳草醛)
(兔耳草醛)
已知:①CH3CHO+CH3CHO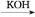 CH3CH(OH)CH2CHO
CH3CH(OH)CH2CHO
②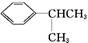 可写成
可写成
(1)B中含氧官能团的名称是 。
(2)上述合成路线中反应①属于 ,反应②属于 (填写反应类型)。
(3)写出由D获得兔耳草醛的化学反应方程式: 。
(4)A的同分异构体中符合以下条件的有 种。
a.能使FeCl3溶液显紫色
b.能发生加聚反应
c.苯环上只有两个互为对位的取代基
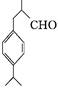
有机物D是一种合成抗高血压药的重要通用中间体,其合成路线如下:(已知A是一种芳香酸)
A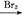
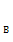
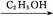 C
C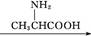
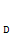
(1)A、C的结构简式分别是 、 ,D中含有的含氧官能团名称是 。
(2)C→D的反应类型是 。
(3)加热条件下,C在足量NaOH水溶液中反应的化学方程式是 。
(4)E是一种相对分子质量比A小14的芳香酸。写出满足下列条件的E的所有同分异构体的结构简式: 。
①能发生银镜反应
②一定条件下可发生水解反应
③分子的核磁共振氢谱中有四组峰
(5)F是B在碱溶液中水解后再酸化的产物。F在一定条件下可聚合成高分子化合物,写出该反应的化学方程式: 。
已知:Ⅲ能与NaHCO3溶液反应,Ⅲ和Ⅳ的相对分子质量相等且Ⅳ催化氧化的产物不能发生银镜反应。
(1)化合物Ⅲ中官能团的名称是 ;Ⅱ不能发生的反应是 。
A.加成反应 B.消去反应
C.酯化反应 D.水解反应
(2)反应③的类型为 。
(3)Ⅴ的结构简式为 ,Ⅰ的结构简式为 。
(4)化合物Ⅵ是Ⅱ的同分异构体,同时符合下列四种条件,则Ⅵ的结构简式为 。
A.苯环上有两个取代基且苯环上的一氯代物有2种
B.能与FeCl3溶液发生显色反应
C.能发生水解反应
D.核磁共振氢谱有6个峰,峰的面积之比为1∶2∶2∶2∶2∶1
(5)化合物Ⅱ发生分子内成环反应的化学方程式为 。
A、B、C、D、E均为有机化合物,转化关系如图所示:
已知:一个碳原子上连有两个羟基时,其结构极不稳定,易发生下列变化,生成较稳定物质: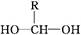

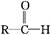
请回答下列问题:
(1)化合物A的分子式: 。
(2)B的结构简式: 。
(3)写出A→B,C→D的有机反应类型:A→B: 反应,C→D: 反应。
(4)B不能发生的反应是 (填序号)。
①氧化反应;②取代反应;③消去反应;④水解反应;⑤加聚反应
(5)写出D与足量的银氨溶液在一定条件下反应的化学方程式: 。
用含少量铁的氧化铜制取氯化铜晶体(CuCl2·xH2O)。有如下操作:
已知:在pH为4~5时,Fe3+几乎完全水解而沉淀,而此时Cu2+却几乎不水解。
(1)氧化剂A可选用 (填编号,下同)。
①Cl2②H2O2③HNO3④KMnO4
(2)要得到较纯的产品,试剂B可选用 。
①NaOH②FeO③CuO④Cu2(OH)2CO3
(3)从滤液经过结晶得到氯化铜的方法是 (按实验先后顺序填编号)。
①过滤②冷却③蒸发浓缩④蒸发至干
(4)为了测定制得的氯化铜晶体(CuCl2·xH2O)中x值,某兴趣小组设计了两种实验方案:
方案一:称取m g晶体灼烧至质量不再减轻为止,冷却、称量所得无水CuCl2的质量为n g。
方案二:称取m g晶体,加入足量10%的氢氧化钠溶液、过滤、洗涤后用小火加热至质量不再减轻为止,冷却、称量所得固体的质量为n g。
①方案一中灼烧CuCl2·xH2O得到无水CuCl2,应在 (填仪器名称)中进行。
方案二中配制一定量10%的氢氧化钠溶液,其操作步骤是计算、称量、 。
②试评价上述两种实验方案,其中可行的方案是 ,另一种方案不可行的理由是 ,若用方案二,计算得x= (用含m、n的代数式表示)。