【化学—选修2:化学与技术】生态工业园区的建设,不仅仅是体现环保理念更要依据循环经济理论和充分考虑经济的可持续发展。下面是某企业设计的硫酸-磷铵-水泥联产,海水-淡水多用,盐-热-电联产三大生态产业链流程图。
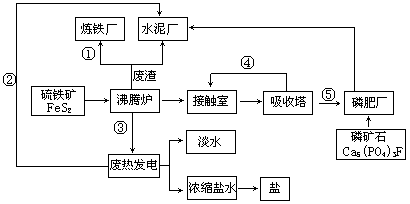
根据上述产业流程回答下列问题:
(1)从原料、能源、交通角度考虑该企业应建在
| A.西部山区 | B.沿海地区 | C.发达城市 | D.东北内陆 |
(2)该流程①、②、③、④、⑤为能量或物质的输送,请分别写出输送的主要物质的化学式或能量形式① ,② ,③ ,④ ,⑤ 。
(3)沸腾炉发生反应的化学方程式 ,磷肥厂的产品是普钙,其主要成份是 (填化学式)。
(4)热电厂的冷却水是 ,该流程中浓缩盐水除提取盐以外还可提取的物质有 (写出一种即可)。
(5)根据生态园区建设理念请提出高炉炼铁厂废气、废渣及多余热能的利用设想 , (请写出两点)。
有机物A为烃类化合物,质谱图表明其相对分子质量为70,其相关反应如下图所示,其中B、D、E的结构中均含有2个—CH3,它们的核磁共振氢谱中均出现4个峰。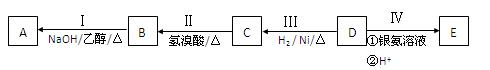
请回答:
(1)D的分子式为;
(2)B中所含官能团的名称为;
(3)Ⅲ的反应类型为(填字母序号);
a.还原反应 b.加成反应 c.氧化反应 d.消去反应
(4)写出下列反应的化学方程式:
Ⅰ:;
Ⅱ:;
C和E可在一定条件下反应生成F,F为有香味的有机化合物,该反应的化学方程式为;
(5)A的同分异构体中有一对互为顺反异构,且结构中有2个—CH3,它们的结构简式为
和;
(6)E的另一种同分异构体能发生银镜反应,能与足量金属钠生成氢气,不能发生消去反应,其结构简式为。
Ⅰ.(1)水分子的立体结构是 ,水分子能与很多金属离子形成配合物,其原因是在氧原子上有。
,水分子能与很多金属离子形成配合物,其原因是在氧原子上有。
(2)冰晶胞中水分子的空间排列方式与金刚石晶胞(其晶胞结构如右图,其中空心所示原子位于立方体的顶点或面心,实心球所示原子位于立方体内)类似。每个冰晶胞平均占有个水分子。冰晶胞与金刚石晶胞微粒排列方式相同的原因是。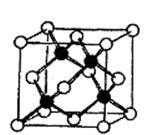
(3)实验测得冰中氢键的作用能为18.5kJ·mol—1,而冰熔化热为5.0kJ·mol-1,这说明。
Ⅱ. (1)碘在不同溶剂中呈现紫色、棕色……一般认为溶液呈紫色的表明溶解了的“碘分子”并未和溶剂发生很强的结合。已知不同温度下,碘在石蜡油中的溶液呈紫色或棕色。请回答:温度低时溶液呈色,温度高时溶液呈色,因为。
(2)在水晶的柱面上涂一层石蜡,用红热的针接触面中央,石蜡熔化后呈椭圆形;用玻璃代替水晶重复上述操作,熔化的石蜡则呈圆形。试用你所学过关于晶体性质的知识解释上述现象。
Ⅰ. 金属铝的生产是以Al2O3为原料,在熔融状态下进行电解:
金属铝的生产是以Al2O3为原料,在熔融状态下进行电解: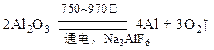
请回答下列问题: (1)冰晶石(Na3AlF6)的作用是 。
(1)冰晶石(Na3AlF6)的作用是 。 (2)电解生成的金属铝是在熔融液的 (填“上层”或“下层”)。
(2)电解生成的金属铝是在熔融液的 (填“上层”或“下层”)。 (3)电解时所消耗的电极是 (填“阳极”或“阴极”)。
(3)电解时所消耗的电极是 (填“阳极”或“阴极”)。 (4)铝是高耗能产品,废旧铝材的回收利用十分重要。在工业上,最能体现节能减排思想的是将回收铝做成 (填代号)。
(4)铝是高耗能产品,废旧铝材的回收利用十分重要。在工业上,最能体现节能减排思想的是将回收铝做成 (填代号)。 a.冰晶石 b.氧化铝 c.铝锭 d.硫酸铝
a.冰晶石 b.氧化铝 c.铝锭 d.硫酸铝
Ⅱ.钢铁工业对促进经济和社会发展起了重要作用。
(1)炼铁高炉分为五部分,铁矿石与高温煤气主要在_________部分发生反应
(2)炼钢时,除磷的化学方程式为_________;加入硅、锰和铝的目的是_______。
(3)不锈钢含有的Cr元素是在炼钢过程的氧吹_______(填“前”或“后”)加入,
原因是_____________。
(4)炼铁和炼钢生产中,尾气均含有的主要污染物是_________。从环保和经济角度考虑,上述尾气经处理可用作________。
“低碳循环”引起各国的高度重视,而如何降低大气中CO2的含量及有效地开发利用CO2,引起了全世界的普遍重视。所以“低碳经济”正成为科学家研究的主要课题
(1)用电弧法合成的储氢纳米碳管常伴有大量的碳纳米颗粒(杂质),这种颗粒可用如下氧化法提纯,请完成该反应的化学方程式:
___ C+ ___ KMnO4+ ____ H2SO4→____CO2↑+ ____MnSO4 + ____K2SO4+ ____H2O
(2)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应
CO(g)+H2O(g) CO2(g)+H2(g),得到如下三组数据:
CO2(g)+H2(g),得到如下三组数据:
| 实验组 |
温度℃ |
起始量/mol |
平衡量/mol |
达到平衡所需时间/min |
||
| CO |
H2O |
H2 |
CO |
|||
| 1 |
650 |
4 |
2 |
1.6 |
2.4 |
6 |
| 2 |
900 |
2 |
1 |
0.4 |
1.6 |
3 |
| 3 |
900 |
a |
b |
c |
d |
 t t |
①实验1条件下平衡常数K=(取小数二位,下同)。
②实验3中,若平衡时,CO的转化率大于水蒸气,则a/b 的值_______(填具体值或取值范围)。
③实验4,若900℃时,在此容器中加入10molCO,5molH2O,2molCO2,5molH2,则此时V正V逆(填“<”,“>”,“=”)。
(3)已知在常温常压下:
① 2CH3OH(l) + 3O2(g) = 2CO2(g) + 4H2O(g)ΔH = -1275.6 kJ/mol
② 2CO (g)+ O2(g) = 2CO2(g)ΔH = -566.0 kJ/mol
③ H2O(g) = H2O(l)ΔH = -44.0 kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:
⑷为最近有科学家提出构想:把空气吹入碳酸钾溶液,然后再把CO2从溶液中提取出来,经化学反应后使之变为可再生燃料甲醇。该构想技术流程如下: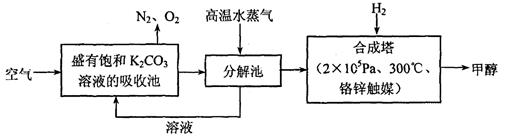
向分解池中通入高温水蒸气的作用是_______________________________
(5)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其Ksp=2.8×10—9。CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为2×10—4mo1/L ,则生成沉淀所需CaCl2溶液的最小浓度为。
下图中的B~K分别代表有关反应的一种反应物或生成物,其中A、C、F、K是固体;E是常见的气体单质,I是红棕色的气态氧化物。固态物质A(混合物)加热后生成的气体混合物若通过碱石灰只剩余气体B,若通过浓硫酸则只剩余气体D。各物质间的转化关系如下图所示:
请回答下列问题: 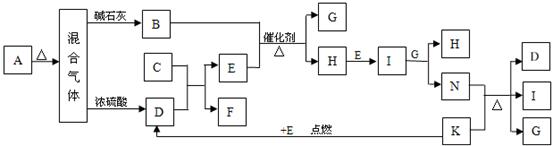
(1)B的化学式为_____________________, D的电子式_________________________.
(2) 写出实验室检验A物质中含有的阳离子的方法 。
(3) 写出实验室制取B的化学方程式 。
(4) 将0.01mol D通入 1L 0.01mol/L F溶液中,所得溶液中所含离子浓度由大到小排列顺序为。
(5) 写出N的稀溶液与过量的铁粉反应的离子方程式 。
(6) 若混合气体通过碱石灰得到的气体B与通过浓硫酸得到的气体D的物质的量之比是8∶5,则用物质的量的关系表示此固体A的组成为 。