用MnO2和浓盐酸制取纯净干燥的氯气,并让氯气与铜粉反应制取纯净的无水CuCl2,装置如下图所示。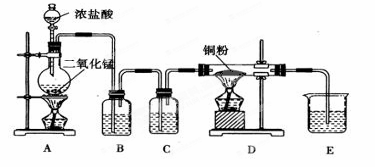
回答下列问题:
(1)B中选用的试剂是饱和食盐水,其作用是__________;C中选用的试剂是__________,其作用是_________
(2)D中反应的化学方程式是_____________,将此生成物溶于少量水,得到______________色溶液。
(3)某学生应用如图所示的方法研究物质的性质,其中气体X的主要成分是氯气,杂质是空气和水蒸气。回答下列问题:
①该项研究(实验)的主要目的是____________________________。
②与研究目的直接相关的实验现象是________________________。
③从物质性质的方面来看,这样的实验设计还存在事故隐患,事故表现是____________。
④请在图中的D处以图的形式表明克服事故隐患的措施。
海水中含有非常丰富的化学资,从海水中可提取多种化工原料。下图是某工厂对海水资综合利用的示意图。
试回答下列问题:
(1)我国规定食用盐中必须加入一定量的KIO3(碘酸钾),其中碘元素的化合价为 价。
(2)为除去粗盐中的Ca2+、Mg2+、SO42-及泥沙,方法是将粗盐溶于水,然后进行下列五项操作:①过滤;②加过量的氢氧化钠溶液;③加适量的盐酸;④加过量的碳酸钠溶液;⑤加过量的氯化钡溶液,合理的操作顺序是 (填序号)。
(3)写出电解饱和食盐水的化学方程式 ,当转移0.2mol电子时,阴阳两极生成的气体体积之和是 (标准状况下)。
(4)以海边贝壳为原料可以制取石灰乳,贝壳的主要化学成分为 (写化学式)。
(5)目前,世界上生产的镁有60%自海水,由“母液”制“镁”的过程中,发生了 个复分解反应(填数目)。
(6)电解氯化镁所得的氯气,除用于生产盐酸外,还可以用于制取漂白粉,漂白粉的有效成份是 (写化学式)。
(7)溴主要以Br-形式存在于海水中,提取食盐后剩下的母液(也叫卤水)中,Br-的浓度较大,工业上 制备的Br2的操作步骤为:一定条件下,将Cl2通入卤水中,生成Br2,利用热空气将Br2吹出,Br2可用热空气吹出,其原因是 。
(10分)某学生利用以下装置探究氯气与氨气之间的反应。其中A、F分别为氨气和氯气的发生装置,C为纯净干燥的氯气与氨气反应的装置。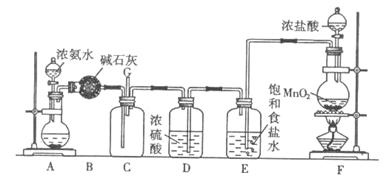
请回答下列问题:
(1)装置F中发生反应的离子方程式为 。
(2)装置A的烧瓶中可装试剂为 。
(3)B装置的名称是 ; E装置的作用是 。
(4)通入C装置的两根导管左边较长、右边较短,目的是 。
(5)装置C内出现浓厚的白烟并在容器内壁凝结,另一生成物是空气的主要成分之一。请写出反应的化学方程式: 。当有a mol氯气参加反应时,转移的电子总数为b个,则阿伏加德罗常数为(a、b的代数式表示) 。
(6)从装置C的G处逸出的尾气中可能含有黄绿色的有毒气体,如何处理? 。
氨气在工农业生产中有重要的用途。某校甲、乙两个化学小组分别对氨的相关实验进行了研究。
(1)甲、乙两小组选择了不同方法制取氨气,
请将实验装置的字母编号和制备原理填写在下表空格中。
| 实验装置 |
实验药品 |
制备原理 |
|
| 甲小组 |
A |
氢氧化钙、氯化铵 |
反应的化学方程式为 ① |
| 乙小组 |
② |
浓氨水、氢氧化钠 |
用化学平衡原理分析氢氧化钠的作用: ③ |
(2)甲组通过右图装置(尾气处理装置已略去)验证了氨有还原性,装置中的实验现象是____ ,硬质玻璃管中氨发生催化氧化反应的化学方程式为 。
(3)甲组将足量氨气不断通入滴有酚酞的AgNO3溶液中,现象为 ,
反应结束所得溶液中除了H+、OH-、NH4+外还主要含有的离子有 。
(4)乙组欲制备氮化镁,查阅资料发现氨跟氧化铜反应可以制备氮气(2NH3+3CuO 3Cu+N2+3H2O),而氮气跟镁在高温下反应可得到氮化镁,但氮化镁遇水立即反应生成Mg(OH)2和NH3。乙组提出了如下制备氮化镁的实验方案示意框图(实验前系统内空气已排除;图中箭头表示气体的流向)。你认为此方案是否正确,并说明理由 。
3Cu+N2+3H2O),而氮气跟镁在高温下反应可得到氮化镁,但氮化镁遇水立即反应生成Mg(OH)2和NH3。乙组提出了如下制备氮化镁的实验方案示意框图(实验前系统内空气已排除;图中箭头表示气体的流向)。你认为此方案是否正确,并说明理由 。
含硫物质燃烧会产生大量烟气,主要成分是SO2、CO2、N2、O2 。某研究性学习小组在实验室利用下列装置制备模拟烟气,并测算模拟烟气通过转化器的脱硫效率。
回答下列问题:
Ⅰ.模拟烟气的制备
(1)用A装置制SO2,化学反应方程式为 。
(2)用B装置制CO2,使用该装置优点的是 。
(3)将制得的气体与空气充分混合,获得模拟烟气用于后续实验。
II.测定烟气中SO2的体积分数
(4)将部分模拟烟气缓慢通过C、D装置,其中C、D中盛有的药品分别是 、 。(填序号)
①KMnO4溶液;②饱和NaHSO3溶液;③饱和Na2CO3溶液;④饱和NaHCO3溶液
(5)若模拟烟气的流速为amL/min,若t1分钟后,测得量筒内液体体积为VmL,则SO2的体积分数是 。
Ⅲ.测算模拟烟气通过转化器的脱硫效率(已转化的SO2占原有SO2的百分比)
(6)将模拟烟气通过转化器E装置,E装置中盛有FeCl2、FeCl3的混合溶液,常温下,它可催化SO2与O2的反应,以达到脱硫目的。写出催化剂参与反应过程的离子方程式 ①SO2+2H2O+2Fe3+=SO42-+2Fe2++4H+② 。
(7)若模拟烟气仍以amL/min的流速通过转化器E装置,t2分钟后,向E装置中加入酸化的BaCl2溶液得到白色浑浊液,经 、洗涤、 、称量,得到mg固体。若实验的气体体积已折算为标准状况,则该转化器的脱硫效率是 。
下图为某套实验装置示意图,其中加热装置和部分药品等均已经省略(装置①和装置②为气体发生装置)。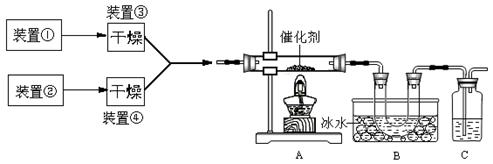
(1)甲同学用此装置(在A、B间增加一盛有浓硫酸的洗气瓶)制备NO2并验证其性质。装置①用于实验室制备NH3,用装置②制备过量O2。装置①中发生反应的化学方程式是 。B处冰水冷却的U型管中有红棕色气体生成且越接近U型管底部颜色越浅,请解释原因 。
(2)乙同学用此套装置合成SO3,B处冰水冷却的U型管中有固体出现。C中若盛放酸性K2Cr2O7溶液,则在C中发生的氧化还原反应的离子方程式是 (生成物中Cr以Cr3+形式存在);现欲制得纯净干燥的SO3,若C中盛放NaOH溶液,则此装置中存在明显不足,应如何改进 (从下面给出的实验装置中选择字母标号补充或替换,并用简要文字说明补充和替换的位置)。
(3)丙同学拟验证NO能被氨气还原并测算其转化率(装置①、装置②分别制NO和NH3),将上述装置A、B、C分别换成下列⑤、⑥、⑦。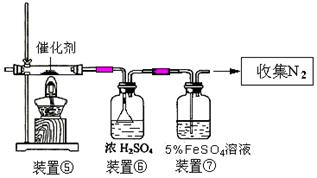
请回答:装置⑦的作用可能是 ;若进入装置⑤的NO共22.4L(已折算为标准状况,下同),氨气过量,最后收集到标准状况下11.2LN2,则NO的转化率是 。