(18分)Ⅰ.将广泛应用于航空工业的某合金(两种金属组成)投入过量浓硝酸中,合金与硝酸剧烈反应,放出红棕色气体X和蓝绿色溶液Y。若将少量Y滴入NaCl溶液中,只产生白色沉淀。
(1)氯元素在周期表中的位置 。
(2)组成合金的金属是 (填选项字母)。
| A.Cu,Mg | B.Cu,Al | C.Cu,Fe | D.Cu,Ag |
(3)X是大气污染物之一,利用氨水可以将SO2和X同时吸收处理,原理如下图所示:

NO2被吸收的离子方程式是 。
Ⅱ.某研究小组为了探究仅一种白色粉末状固体X(仅含四种元素)的组成和性质,称取6.3g固体X,设计并完成了如下实验:

已知:Cu2O+2H+==Cu+Cu2++H2O
请回答下列问题:
(1)画出沉淀丙中金属元素的原子结构示意图 ,写出气体甲的电子式 。
(2)X的化学式是 。
(3)生成砖红色沉淀的原因是 (用化学方程式表示)。
(4)在加热条件下,用氢气还原砖红色沉淀,写出该反应的化学方程式 ,有人提出产物中可能还含有Cu2O,请设计实验方案验证之 。
实验室用MnO2、KOH及KClO3为原料制取高锰酸钾的实验流程如下:
(1)熔融时需用铁坩埚和铁制搅拌棒而不能用玻璃仪器,其原因是。
(2)熔融时,MnO2转化为K2MnO4,KClO3转化为KCl,其反应的化学方程式为。
(3)几种物质的溶解度曲线如图所示。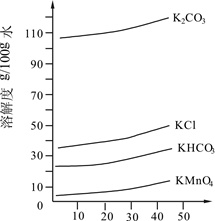
①歧化时,通入CO2至pH为10~11,K2MnO4绿色溶液转化为KMnO4和MnO2。其反应的离子方程式为。
②歧化时不能通入过量CO2的原因是。
③通入CO2后,用玻璃棒蘸取溶液点于滤纸上,观察到,证明歧化反应已发生。
④歧化后得到KMnO4晶体的操作依次为过滤、、及干燥。
(4)在此实验流程中可循环使用的物质的化学式为。
利用硫酸渣(主要含Fe2O3、FeO,杂质为Al2O3和SiO2等)生产铁基颜料铁黄(FeOOH)的制备流程如下: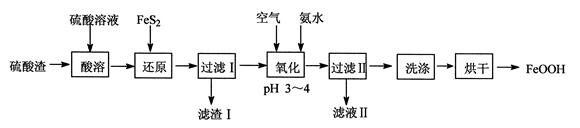
(1)“酸溶”时,Fe2O3与硫酸反应的化学方程式为。
(2)滤渣Ⅰ的主要成分是FeS2、S和(填化学式);Fe3+被FeS2还原的离子方程式为。
(3)“氧化”中,生成FeOOH的离子方程式为。
(4)滤液Ⅱ中溶质是Al2(SO4)3和(填化学式);“洗涤”时,检验铁黄表面已洗涤干净的操作是。
B.【实验化学】
水杨酸可用于制备解热镇痛药阿司匹林。重结晶纯化固体水杨酸的步骤如下:
步骤1:按图1所示装置,在圆底烧瓶中加入1.2 g粗水杨酸,10 mL 30%乙醇和磁子。接通冷凝水后,搅拌加热至沸,直到完全溶解。
步骤2:冷却后,加入活性炭,重新搅拌加热煮沸几分钟后,利用图2装置趁热过滤到锥形瓶中,并在短颈漏斗上盖好表面皿。
步骤3:盛滤液的锥形瓶用塞子塞好,自然冷却后再用冰水冷却,析出水杨酸晶体。
步骤4:用图3所示装置进行抽滤,用少量30%的乙醇洗涤。抽干后得到的晶体转移到表面皿上,放入干燥器中干燥。
步骤5:称量干燥后固体质量为0.81 g。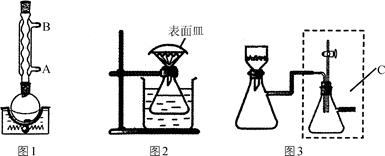
(1)步骤1中接通冷凝水时,冷水应从________(填“A”或“B”)端进。
(2)步骤2中“趁热过滤”的目的是______________________。
(3)步骤3中“自然冷却后再用冰水冷却”,而不直接用冰水浴冷却的目的是________。
(4)步骤4中C装置的作用是______________________________________。
(5)本次实验中,水杨酸的收率为________。确定最终产品是水杨酸的实验或方法是___________。
二氯化二硫(S2Cl2),常温下是一种黄红色液体,有窒息性,刺激性恶臭,熔点80℃,沸点135.6℃,在空气中强烈产生烟雾,遇水、醇即分解;它常用于橡胶的低温硫化和黏接剂,国防工业用作军用毒气。它的工业合成方法:将氯气通入到熔融的硫单质发生反应而制得。实验室用下列装置制取少量S2Cl2。
请回答下列问题:
(1)S2Cl2分子中各原子均达到8电子稳定结构,则它的结构式为。
(2)下列方法都可以制得氯气,其中符合装置A制取的有。
a、MnO2固体和浓HCl共热
b、KMnO4固体和浓HCl反应
c、KClO3固体和浓HCl反应
d、MnO2固体、NaCl固体和浓硫酸共热
(3)装置A中用恒压分液漏斗而不用普通分液漏斗的原因是。
(4)B中饱和食盐水的作用,装置C中的试剂是 。
(5)S2Cl2遇水强烈反应产生烟雾,其产物中有一种气体能使品红溶液褪色,加热后又恢复原状,且反应过程中只有一种元素化合价发生变化,写出该反应的化学方程式,其氧化剂与还原剂物质的量之比为。
(6)从安全和环保方面考虑,补全F方框内剩下的装置并注明装置中的药品。画图时,仪器可以简化,如下列仪器可以分别表示为: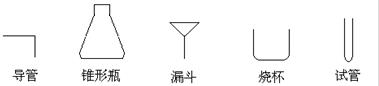
(14)铬是一种银白色金属,化学性质稳定,以+2、+3和+6价为常见价态。工业上以铬铁矿(主要成分为FeO·Cr2O3 ,含有Al2O3、SiO2等杂质)为主要原料生产金属铬和重铬酸钠Na2Cr2O7·2H2O(已知Na2Cr2O7是一种强氧化剂),其主要工艺流程如下:
查阅资料得知:
①常温下,NaBiO3不溶于水,有强氧化性,在碱性条件下,能将Cr3+转化为CrO42-
②常温下,Ksp[Cr(OH)3]=6.3×10-31
回答下列问题:
(1)工业上常采用热还原法制备金属铬,写出以Cr2O3为原料,利用铝热反应制取金属铬的化学方程式。
(2)酸化滤液D时,不选用盐酸的原因是。
(3)固体E的主要成分是Na2SO4,根据下图分析操作a为、。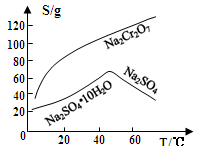
(4)已知含+6价铬的污水会污染环境。电镀厂产生的镀铜废水中往往含有一定量的Cr2O72-,处理该废水常用还原沉淀法,具体流程如下:
①Cr(OH)3的化学性质与Al(OH)3相似。在上述生产过程中加入NaOH溶液时要控制溶液的pH不能过高,是因为;
②下列溶液中可以代替上述流程中Na2S2O3溶液的是(填选项序号);
| A.FeSO4溶液 | B.浓H2SO4 | C.酸性KMnO4溶液 | D.Na2SO3溶液 |
③调整溶液的pH=5时,通过列式计算说明溶液中的Cr3+是否沉淀完全;
④上述流程中,每消耗0.1molNa2S2O3转移0.8mole-,则加入Na2S2O3溶液时发生反应的离子方程式为。