实验室用MnO2、KOH及KClO3为原料制取高锰酸钾的实验流程如下:
(1)熔融时需用铁坩埚和铁制搅拌棒而不能用玻璃仪器,其原因是 。
(2)熔融时,MnO2转化为K2MnO4,KClO3转化为KCl,其反应的化学方程式为 。
(3)几种物质的溶解度曲线如图所示。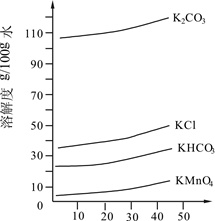
①歧化时,通入CO2至pH为10~11,K2MnO4绿色溶液转化为KMnO4和MnO2。其反应的离子方程式为 。
②歧化时不能通入过量CO2的原因是 。
③通入CO2后,用玻璃棒蘸取溶液点于滤纸上,观察到 ,证明歧化反应已发生。
④歧化后得到KMnO4晶体的操作依次为过滤、 、 及干燥。
(4)在此实验流程中可循环使用的物质的化学式为 。
CaCO3广泛存在于自然界,是一种重要的化工原料。大理石主要成分为CaCO3,另外有少量的含硫化合物。实验室用大理石和稀盐酸反应制备CO2气体。下列装置可用于CO2气体的提纯和干燥。
完成下列填空:
(1)用浓盐酸配制1∶1(体积比)的稀盐酸(约6 mol·L-1),应选用的仪器是。
a.烧杯 b.玻璃棒 c.量筒 d.容量瓶
(2)上述装置中,A是,NaHCO3溶液可以吸收。
(3)上述装置中,B物质是。用这个实验得到的气体测定CO2的相对分子质量,如果B物质失效,测定结果(填“偏高”、“偏低”或“不受影响”)。
(4)一次性饭盒中石蜡(高级烷烃)和CaCO3在食物中的溶出量是评价饭盒质量的指标之一,测定溶出量的主要实验步骤设计如下:
剪碎、称重→浸泡溶解→过滤→残渣烘干→冷却、称重→恒重
为了将石蜡和碳酸钙溶出,应选用的试剂是。
a.氯化钠溶液 b.稀醋酸 c.稀硫酸 d.正己烷
(5)在溶出量测定实验中,为了获得石蜡和碳酸钙的最大溶出量,应先溶出,后溶出。
(6)上述测定实验中,连续,说明样品已经恒重。
一位学生对铁与氧化铁反应后的产物进行探究。
(1)提出假设
假设1:产物为FeO;
假设2:。
(2)查阅资料
该学生通过查阅资料得知:在铁的三种氧化物中,四氧化三铁最稳定,氧化亚铁最不稳定,常温下极易被氧气氧化成氧化铁(颜色由黑色变成红色)。
通过查阅资料可以得出的初步结论为。
(3)进行实验
该学生设计了如下装置进行铁与氧化铁反应的实验。请你帮助他将实验步骤补充完整。
①按如图装置连接好仪器(暂不装入药品),。
②称取1 g还原性铁粉和5 g氧化铁粉末,混合均匀后平摊在玻璃管中部。
③松开两个弹簧夹,,即可夹上弹簧夹a,并开始加热药品。
④大约4分钟左右,棕色粉末全部变黑;再夹上弹簧夹b,然后停止加热,等到玻璃管冷却至室温,倒出黑色粉末。
(4)现提供如下药品,验证实验得到的黑色粉末的成分。磁铁、稀盐酸、KSCN溶液、酸性KMnO4溶液、试管、胶头滴管。
| 实验步骤 |
预期现象和结论 |
(5)实验结论:铁与氧化铁反应的化学方程式为。
某学生利用以下装置探究氯气与氨气之间的反应。其中A、F分别为氨气和氯气的发生装置,C为纯净干燥的氯气与氨气反应的装置。
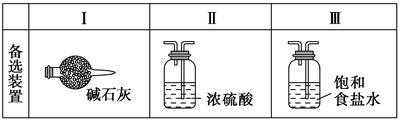
请回答下列问题:
(1)装置F中发生反应的离子方程式:。
(2)装置A中的烧瓶内固体可选用(选填以下选项的代号)。
A.碱石灰
B.生石灰
C.二氧化硅
D.五氧化二磷
E.烧碱
(3)虚线框内应添加必要的除杂装置,请从上图的备选装置中选择,并将编号填入下列空格:B,D,E。(均填编号)
(4)氯气和氨气在常温下相混就会反应生成氯化铵和氮气,装置C内出现浓厚的白烟并在容器内壁凝结,请设计实验方案鉴定该固体就是氯化铵:。
(5)从装置C的出气管口处逸出的尾气可能含有污染环境的气体,如何处理?。
新制氯水中含有多种粒子,某校化学研究性学习小组的同学为探究其性质,做了如下实验,请你帮助完成:
(1)HClO不稳定,见光易分解生成HCl和O2。请设计实验证明有O2生成。
(2)氯气能使湿润的红色布条退色。对于使湿润的红色布条退色的物质,同学们的看法不一致,认为氯水中存在的几种粒子都有可能。请你设计实验,得出正确结论。
| 提出问题 |
收集资料 |
提出假设 |
验证假设 |
得结论出 |
| 氯水中何种物质能使湿润的红色布条退色? |
①氯气有强氧化性 ②氯气与冷水反应生成盐酸和次氯酸 ③次氯酸有强氧化性 |
① ② ③ ④H2O使布条退色 |
①:实验①:把红色干布条放入充满氯气的集气瓶中,布条不退色 实实验②:; 实验③:把红色布条放在水里,布条不退色 |
为了探究过氧化钠的强氧化性,某研究性学习小组设计了如图所示的实验装置。
实验步骤及现象如下:
①检查装置气密性后,装入药品并连接仪器。
②缓慢通入一定量的N2后,将装置D连接好(导管末端未伸入集气瓶中),再向圆底烧瓶中缓慢滴加浓盐酸,剧烈反应,有气体产生。
③一段时间后,将导管末端伸入集气瓶中收集气体。装置D中收集到能使带火星的木条复燃的无色气体。
④反应结束后,关闭分液漏斗的活塞,再通入一定量的N2,至装置中气体无色。
回答下列问题:
(1)装置B中湿润的红色纸条退色,证明A中反应有(填化学式)生成。若B中改放湿润的淀粉KI试纸,仅凭试纸变蓝的现象不能证明上述结论,请用离子方程式说明原因。
(2)装置C的作用是。
(3)甲同学认为O2是Na2O2被盐酸中的HCl还原所得。乙同学认为此结论不正确,他可能的理由为①;②。
(4)实验证明,Na2O2与干燥的HCl能反应,完成并配平该化学方程式。 Na2O2+
Na2O2+ HCl=
HCl= Cl2+
Cl2+ NaCl+
NaCl+ 该反应(填“能”或“不能”)用于实验室快速制取纯净的Cl2,理由是(要求答出两点)。
该反应(填“能”或“不能”)用于实验室快速制取纯净的Cl2,理由是(要求答出两点)。