在固定容积为1.00L的容器中,通入一定量的N2O4,发生反应N2O4(g) 2NO2(g)随温度升高,混合气体的颜色变深。回答下列问题:
2NO2(g)随温度升高,混合气体的颜色变深。回答下列问题:

(1)反应的△H 0(填“大于”“小于”);100℃时,体系中各物质浓度随时间变化如上图所示。在0~60s时段,反应速率v(N2O4)为 。反应的平衡常数K1= 。
(2)100℃时达到平衡后,改变反应温度为T,c(N2O4)降低,经10s又达到平衡。
①T 100℃(填“大于”“小于”),判断理由是 。
②100℃时达到平衡后,向容器中再充入0.20mol NO2气体,新平衡建立后,NO2的体积分数
(填“增大”、“不变”或“减小”)
(3)温度T时反应达平衡后,将反应容器的容积减少一半,平衡向 (填“正反应”或“逆反应”)方向移动,判断理由是 。
在一定温度下,将2molA和2molB两种气体混合放入体积为2L的密闭刚性容器中,发生如下反应: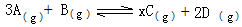
2min末反应达到平衡,生成0.8molD,并测得C的浓度为0.4mol•L-1请回答:
(1)x的值为_______(2)A的转化率为________
(3)此温度下该反应的平衡常数K=
(4)若在同样的条件下,开始时加入C 、 D 各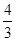 mol,要使平衡时各物质的百分含量与上述平衡相同,则还要加入______mol______ 物质.
mol,要使平衡时各物质的百分含量与上述平衡相同,则还要加入______mol______ 物质.
(5)保持温度不变,往同一容器中通入A、B、C、D各1mol,该反应向方向移动。
将足量AgCl分别放入:①5ml水②10ml 0.2mol·L-1 MgCl2溶液③20ml 0.5mol·L-1 NaCl溶液,④40ml 0.1mol·L-1盐酸中溶解溶解至溶液饱和,各溶液中Ag+的浓度分别为a、b、c、d,它们由大到小的排列顺序是_____________________;0.2mol·L-1 NH4Cl溶液中离子浓度大小关系是_______________。
写出符合要求的离子方程式:
(1)漂白粉与洁厕剂等强酸性物质混合使用会生成一种有毒气体_____________。
(2)泡沫灭火器的反应原理:___________ ________________________________。
丁子香酚可用于配制康乃馨型香精及制作杀虫剂和防腐剂,结构简式如图。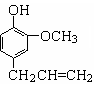
(1)丁子香酚分子式为。
(2)下列物质在一定条件下能跟丁子香酚反应的是。
a.NaOH溶液 b.NaHCO3溶液 c.FeCl3溶液 d.Br2的CCl4溶液
(3)符合下述条件的丁子香酚的同分异构体共有_____种,写出其中任意两种的结构简式。
① 与NaHCO3溶液反应② 苯环上只有两个取代基 ③ 苯环上的一氯取代物只有两种
__________________、_________________。
(4)丁子香酚的某种同分异构体A可发生如下转化(部分反应条件已略去)。
提示:RCH="CHR’" 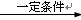 RCHO+R’CHO
RCHO+R’CHO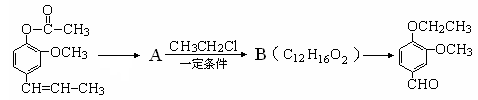
A→B的化学方程式为_____________________________________,
A→B的反应类型为______________________。
X、Y、Z、W是短周期的四种元素,有关他们的信息如下表所示。
| 元素 |
部分结构知识 |
部分性质 |
| X |
X的单质由双原子分子构成,分子中有14个电子 |
X有多种氧化物,如XO、XO2、X2O4等;通常情况下XO2与X2O4共存 |
| Y |
Y原子的次外层电子数等于最外层电子数的一半 |
Y能形成多种气态氢化物 |
| Z |
Z原子的最外层电子数多于4 |
Z的最高正化合价与最低负化合价代数和为6 |
| W |
W原子的最外层电子数等于2n-3(n为原子核外电子层数) |
化学反应中W原子易失去最外层电子形成Wn+ |
填写下列空白:(提示:不能用字母X、Y、Z、W作答)
(1)X的气态氢化物分子的电子式是,Z元素在周期表中的位置是。
(2)X、Y、Z三元素的最高价氧化物的水化物酸性由强到弱的顺序是。
(3)常温时,W的硫酸盐溶液的pH7(填“=”、“>”或“<”),理由是:(用离子方程式表示)。
(4)实验室用X的氢化物的水溶液制取W的氢氧化物的方法是(用离子方程式表示)
。
(5)25℃、101 kPa时,32 g Y的最低价气态氢化物完全燃烧生成稳定的氧化物时放出1780.6 kJ的热量,写出该反应的热化学方程式。