兴趣小组的同学在做镁条和盐酸反应实验时发现,试管外壁很烫,试管口出现白雾。白雾是什么呢?
Ⅰ.同学们作出猜想
猜想一:是小水滴。因为盐酸溶液中的水受热会汽化上升,在试管口 (填物态变化名称)成小水滴。
猜想二:是盐酸小液滴。因为浓盐酸具有 性,可能实验中使用的盐酸浓度过高,试管口就会形成盐酸小液滴。
同学们将干燥的蓝色石蕊试纸放在内有正在反应的镁条和盐酸的试管口,试纸变红,证明猜想二是合理的。
Ⅱ.小柯提出质疑
为什么刚才打开盛放实验所用盐酸的试剂瓶,瓶口没有白雾,却在反应过程中出现白雾?
小柯联系反应时试管外壁很烫,于是猜想:白雾的形成可能与温度有关。
他用试管取少量盐酸,将干燥的蓝色石蕊试纸放在试管口,试纸不变红;然后 (填操作),试纸变红。
得出结论:这种盐酸浓度并不高,是镁和盐酸反应放热促使盐酸形成白雾。
某气体可能由以下气体中的一种或几种组成:①水蒸气②CO③H2④CO2。某同学设计了如图示的装置进行实验,A、B、C、D瓶可根据需要盛装物质。请根据要求回答问题: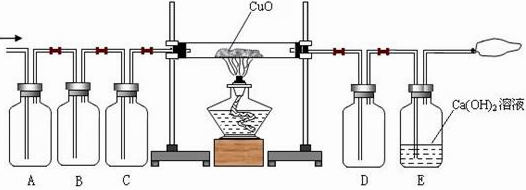
(1)如果此气体是由①②③三种气体组成,若用干燥的还原性气体和CuO反应,且能观察到A瓶中固体物质有明显的颜色变化,则A瓶装的固体物质可能是(填化学式)
(2)如果此气体是由①②③④四种气体组成,则B瓶装的物质可能是(填物质名称),C瓶装的物质可能是(填物质名称)。
(3)当经过A、B、C装置后的干燥气体与CuO在加热的条件下充分反应,若D瓶中没有发生明显变化(D瓶中装有与A装中相同的固体物质),E瓶中有沉淀产生。则原混合气体中一定不含(填气体编号)
(4)如果有①②③④四种气体经过A、B、C装置,且B瓶中盛装的物质是碱溶液,请写出在B瓶中发生的化学反应方程式:
在学习碳酸钠的性质的课堂上,老师在碳酸钠溶液中加入一定量的澄清石灰水产生白色沉淀,在滤出沉淀后的滤液,引导同学们对滤液中溶质的成分进行探究。同学们通过讨论认为溶质是NaOH、Na2CO3、Ca(OH)2中的一种或两种,其可能情况有三种:①NaOH;②NaOH和Na2CO3;③。
小伟同学设计了下列实验方案,请你帮助完成。
| 实验步骤 |
可能出现的实验现象 |
实验结论 |
| ⑴取少量滤液于试管中,加入碳酸钠溶液 |
产生 |
假设③成立 |
| ⑵取少量滤液于试管中,加入足量稀盐酸 |
放出无色气体 |
假设成立 |
| ⑶取少量滤液于试管中,加入碳酸钠溶液或足量稀盐酸 |
没有明显现象 |
假设成立 |
小强根据小伟设计的实验方案,在滤液中加入足量稀盐酸,观察到有大量气泡产生,产生该现象化学方程式为。因此他得出的结论是只有假设成立,该假设成立说明教师做的实验是(选填“恰好完全反应”、“Ca(OH)2过量”或“Na2CO3过量”)
化学课上,老师向盛有少量碳酸钠溶液的试管中加入一定量的澄清石灰水,出现了白色沉淀,反应的化学方程式是Na2CO3+Ca(OH)2=CaCO3↓+2NaOH。据此现象,老师提出如下问题,请回答:
(1)反应后溶液中溶质是什么?
小明认为有以下四种情况,请你替他补充完整:
情况①:
情况②:NaOH和Na2CO3
情况③:NaOH和Ca(OH)2
情况④:NaOH、Na2CO3和Ca(OH)2
小红认为只有三种情况,其中情况(填序号)不可能,理由是。
(2)为了进一步确定反应后溶液的成分,小强设计了如下实验方案:
实验步骤 |
实验现象 |
实验结论 |
| 取少量溶液于试管中,滴加过量稀盐酸 |
无明显现象 |
情况(填序号)不可能 |
| 另取少量溶液于试管中,加入 |
情况③正确 |
同学们的回答,得到了老师满意的赞赏。
某研究型学习小组的同学在用浓硫酸处理废锌片时发现产生的气体具有刺激性气味,这种现象引起同学们的思考和研究。
【提出猜想】对产生的气体进行猜想:
猜想1:可能是H2;
猜想2:可能是SO2;
猜想3:可能是
【查阅资料】SO2易溶于水,能与NaOH溶液反应生成Na2SO3。
【实验方案】研究性学习小组的同学设计如图所示的装置进行研究(夹持仪器已省略,假设装置中的反应都进行完全)。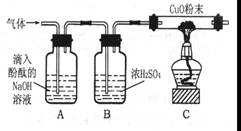
【问题讨论】
(1)如果装置A中没有明显现象,装置C中的现象为则猜想成立。
(2)如果装置A中的现象为,装置C中没有明显的现象则猜想成立。
(3)猜想3成立的实验现象是
。
(4)装置B中浓硫酸的作用是。
【思维拓展】
实验室中可以用氢氧化钠溶液吸收二氧化硫,反应的化学方程式是
。
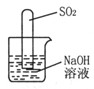
(2)小组内一同学又设计了判断SO2与NaOH溶液能否反应的装置(如图),实验时发现试管内液面上升,就得出SO2与NaOH溶液反应的结论,其同学认为这一结论不严谨,理由是。要得到科学严谨的结论,仍利用该装置,需做的对比实验是
。
(1)实验室给你提供了下列仪器,请选用合适的仪器完成指定的实验。

①要制取较多的O2用来探究其性质(要求制取过程中可以添加反应物),组装气体发生装置需要的仪器是___ ___(填序号),收集氧气应采取___ _____法。
②提纯粗盐时,过滤需要选用上述仪器中的_____ ____(填序号),除此之外还缺少的仪器是____ _____、____ ______(填名称)。
(2)美羊羊同学在购买回的袋装薯片中发现还有一个小袋,上面标有“成分:CaO、Fe;作用:防潮、防氧化;警告:禁止食用”等字样,撕开小袋,发现里面的固体粉末有少许是棕红色的,大多数是灰白色的。经过分析,她认为棕红色粉末是Fe2O3,灰白色粉末应该含有CaCO3和Fe,为验证自己的判断,美羊羊同学打算进行实验探究,请你一同参与。
【实验目的】证实灰白色粉末中含有CaCO3和Fe。
【实验设计】装置如下图所示:

【实验预测与分析】
①若要证实样品中含有CaCO3,观察到的实验现象是_______ ____________,B中发生反应的化学方程式为___ _____。
②若要证实样品中含有Fe,E中应观察到的现象是____ _________,此时C装置的作用是____ ____________。
③看了美羊羊同学的分析结论,有同学认为小袋内灰白色粉末中还应该有别的物质,请你写出其中一种物质的化学式__________。