【2015年山东省济南市】构建安全体系,建设小康社会,关系国计民生。近期,媒体报道的某些环境问题、卫生问题和安全问题引发了人们的关注:
(1)据报道:“济南俩月查处了13家‘铝包子’铺”,所谓‘铝包子’是指所用面粉中非法加入了含有硫酸铝铵[NH4Al(SO4)2.12H2O]成分的泡打粉,食物中铝元素超标,危害身体健康。在硫酸铝铵中,所含非金属元索共有__________种。
(2)露天烧烤不仅污染环境、导致周边空气中PM2.5指数严重超标,在烧烤的肉类食物中还含有强致癌物质一一苯并 (a) 芘(化学式为C2OH12),在苯并 (a) 芘中,氢元素与碳元素的原子个数之比为_________(填最筒整数比)。
(3)据报道:2015年5月6日在104国道某段,一辆载有20多吨浓硫酸的罐车不慎侧翻,造成大量硫酸泄漏。有关部门调来大量熟石灰粉[主要成分为Ca(OH)2]和沙土用于清除泄漏的硫酸。试写出硫酸和熟石灰反应的化学方程式:______________________________。
(4)世界卫生组织将5月3 1日定为“世界无烟日”,我国采取了公共场所禁止吸烟等控烟措施。吸烟有害健康,我国遭受二手烟危害的非吸烟人口就多达7.4亿。烟雾中主要含有一氧化碳、尼古丁(C10H14N2)和焦油,这三种物质被称为香烟的三大杀手。下列有关说法中,正确的是_________(填写序号A、B、C、D之一)
①生活中应拒绝毒品 ②焦油能诱发细胞病变 ③吸烟对他人无害
④“煤气”中毒是由一氧化碳引起的 ⑤在尼古丁中氮元素的含量最高
A.①④⑤ B.①②③ C.①②④ D.②③⑤
初中阶段:物质得氧和失氧的反应是氧化还原反应;高中阶段:凡是有元素化合价升降的化学反应都是氧化还原反应.元素化合价升高的为还原剂,发生氧化反应;元素化合价降低的为氧化剂,发生还原反应;氧化反应和还原反应同时发生的,这样的反应称为氧化还原反应.请回答下列问题:
(1)根据化合价改变判断下列四种基本反应类型,一定不是氧化还原反应的是 .(选填序号)
A.化合反应 B.分解反应 C.置换反应 D.复分解反应
(2)下列化学反应中,属于氧化还原反应的是 (选填序号),该反应的还原剂是 (填化学式).
| A. |
Na 2CO 3+CaCl 2═CaCO 3↓+2NaCl |
B. |
Fe+CuSO 4═Cu+FeSO 4 |
| C. |
Ca(HCO 3) 2 |
D. |
CaO+H 2O═Ca(OH) 2 |
(3)下列反应中,氧化反应与还原反应在同一元素中进行的是 .(多选,选填字母序号)
| A. |
Cl 2+2NaOH═NaCl+NaClO+H 2O |
B. |
4P+5O 2 |
| C. |
Zn+CuCl 2═Cu+ZnCl 2 |
D. |
3NO 2+H 2O═2HNO 3+NO. |
在盛有11.9g纯碱样品 ( 含少量氯化钠杂质 ) 的烧杯中加入167.8g水,完全溶解后,再向其中逐滴加入一定质量分数的氯化钡溶液,生成沉淀的总质量与所滴入氯化钡溶液质量关系如图所示:
(1)反应过程中生成沉淀的质量是 g。
(2)在B点时,溶液中含有的溶质是 (写化学式 )
(3)求A点时溶液中的所含溶质质量分数。 写出计算过程

氧气是人类生产活动的重要资源。
( 1 )下列属于 O 2 的化学性质的是 (填标号)。
| A. |
O 2能支持燃烧 |
| B. |
O 2的密度比空气的密度略大 |
| C. |
O 2在低温、高压时能变为液体或固体 |
( 2 )小圳同学进行实验室制备 O 2 的相关探究。
【 查阅 】 他得知在 KClO 3 分解制 O 2 的反应中, Fe 2 O 3 可作催化剂。
【 实验 】 他用电子秤称取 0.49g Fe 2 O 3 和一定量的 KClO 3 ,充分混合后加热至 KClO 3 完全分解,冷却至室温,称得剩余固体的质量为 1.98g 。
【计算】①剩余固体中KCl的质量是 g。
② 该反应生成 O 2 的质量(根据化学方程式写出完整的计算步骤)。
【 思考 】 他发现制备 O 2 较慢,猜测 KClO 3 和 Fe 2 O 3 的质量比可能会影响反应的快慢。
【 探究 】 ③ 他调节 KClO 3 和 Fe 2 O 3 的质量比制备 O 2 ,整理数据绘制出如图,从图中得出 KClO 3 和 Fe 2 O 3 最佳质量比是 。
【 结论 】 ④ 根据质量守恒定律,请你计算出小圳同学在 [ 实验 ] 中称取的 KClO 3 的质量为 g , KClO 3 和 Fe 2 O 3 的质量比是 (填最简比),不是最佳质量比。

【2015年江苏省扬州市】含锌废渣和各种锌矿(如菱锌矿)都有着重要的用途
Ⅰ.以含锌废渣(主要成分为ZnO,杂质为FeO﹑CuO)为原料制备七水硫酸锌(ZnSO4·7H2O)的流程如下。
(1)粉碎的目的是 。
(2)若实验室用质量分数为98%的硫酸配制200g25%的硫酸,需要的玻璃仪器有胶头滴管﹑玻璃棒﹑ 和 ,此处玻璃棒的作用是 。
(3)物质X是 ,滤渣中含有的金属单质有 ,除铜时发生的反应属于 反应(填基本反应类型)
(4)流程中获得七水硫酸锌前省略的操作是﹑冷却结晶﹑ 洗涤和低温烘干。
(5)某温度下,Fe(OH)3分解得到一种铁﹑氧质量比21:8的氧化物,该氧化物的化学式 。
(6)除铁过程中,温度pH对除铁效果的影响分别对如图所示。由图可知,除铁时温度应控制在 ℃为宜,pH应控制在 为宜。
Ⅱ.以某菱锌矿(ZnCO3含量为62.5%)为原料制备锌的原理如下(假设杂质不参加反应):
 则100吨这样的菱锌矿理论上最多制得锌多少吨?(写出计算过程)
则100吨这样的菱锌矿理论上最多制得锌多少吨?(写出计算过程)
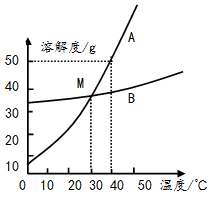
【2015年山东省济南市】1926年,我国著名化学家侯德榜先生创立了侯氏制碱法,促进了我国民族工业的发展和世界制碱技术的进步,其生产过程中有下列反应:
(1)侯氏制碱法所制的“碱”是指_______________。
(2)工业生产过程中,氨盐水吸收二氧化碳后生成碳酸氢钠和氯化铵,在常温下,两者首先从溶液中结晶析出的是_________ 晶体(填物质名称)。
(3)现有Na2CO3和NaCl的混合物样品22.3g,将其放入干净的烧杯中,加一定质量的水使其完全溶解。向所得溶液中逐滴加入溶质质量分数为7.3%的稀盐酸,烧杯中溶液的质量与滴入稀盐酸的质量关系曲线如图所示。试回答下列问题:
①当滴入上述稀盐酸至图中B点时,烧杯中溶液里的溶质为_______________(写化学式)。
②在Na2CO3和NaCl的混合物样鼎中,含Na2CO3的质量为_______________g。
③当滴入上述稀盐酸至图中A点时,试通过计算,求此温度时所得不饱和溶液中溶质的质量(计算结果精确至0.1g)。