【2015年山东省济南市】1926年,我国著名化学家侯德榜先生创立了侯氏制碱法,促进了我国民族工业的发展和世界制碱技术的进步,其生产过程中有下列反应:
(1)侯氏制碱法所制的“碱”是指_______________。
(2)工业生产过程中,氨盐水吸收二氧化碳后生成碳酸氢钠和氯化铵,在常温下,两者首先从溶液中结晶析出的是_________ 晶体(填物质名称)。
(3)现有Na2CO3和NaCl的混合物样品22.3g,将其放入干净的烧杯中,加一定质量的水使其完全溶解。向所得溶液中逐滴加入溶质质量分数为7.3%的稀盐酸,烧杯中溶液的质量与滴入稀盐酸的质量关系曲线如图所示。试回答下列问题:
①当滴入上述稀盐酸至图中B点时,烧杯中溶液里的溶质为_______________(写化学式)。
②在Na2CO3和NaCl的混合物样鼎中,含Na2CO3的质量为_______________g。
③当滴入上述稀盐酸至图中A点时,试通过计算,求此温度时所得不饱和溶液中溶质的质量(计算结果精确至0.1g)。
随着人们生活水平的提高,汽车已经走进千家万户.
(1)在汽车电路中,经常用铜做导线,这是利用铜的延展性和 性.
(2)车体多用钢材制造,钢铁厂用赤铁矿为原料炼铁的原理是(用化学方程式表示) .
(3)为减少汽油燃烧产生的废气对环境的污染,我国开发推广使用一种车用乙醇汽油,其中含乙醇10%.请写出乙醇在空气中完全燃烧的化学方程式 .
对知识的归纳和总结是学习好化学的重要方法。在学习了碱的性质后,小红同学总结了氢氧化钙的四条化学性质(如图所示),即氢氧化钙与图中四类物质能够发生化学反应。
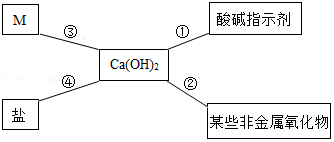
(1)图中M所属的物质类别是 。
(2)氢氧化钙可由生石灰和水反应制得,该放应能 (填"吸收"或"放出")热量。
(3)利用图中氢氧化钙能与 反应的性质,可以解释"用石灰浆粉刷墙壁,干燥后墙壁就变硬了"的现象。
(4)利用图中④氢氧化钙和盐反应的性质,除去氢氧化钠溶液中少量的氢氧化钙杂质。请写出该反应的化学方程式 。
金属材料是重要的资源,在日常生活中已经得到越来越广泛的应用。
(1)将铝片和硬铝片相互刻画,铝片上留下明显的划痕,说明 。
(2)沙漠地区的铁制品锈蚀较慢,其原因是 。
(3)为了比较铁、铜、银三种金属的活动性顺序强弱,某同学设计了下列四种方案:
①将铁丝、银丝分别浸入硫酸铜溶液中;②将银丝分别浸入到硫酸亚铁、硫酸铜溶液中;
③将铜丝、银丝分别浸入到硫酸亚铁溶液中;④将铜丝分别浸入到硫酸亚铁、硝酸银溶液中其中可行的方案是 (填序号)。可行方案中发生的基本反应类型为 。
(4)工业上将赤铁矿石冶炼成铁是一个复杂的过程。炼铁高炉中发生的主要反应有:
①高温下一氧化碳将铁矿石还原为铁;②高温煅烧石灰石;③灼热的焦炭和二氧化碳的反应;④焦炭充分燃烧,其中体现焦炭作用的反应是 (填序号)。
通过一年的化学学习,我们学会了从微观角度认识物质。
(1)如图是部分原子的结构示意图请回答问题:
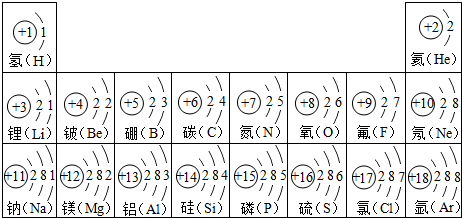
①化学上将质子数为 的所有氯原子统称为氯元素。
②8号元素和地壳中含量最多的金属元素组成的化合物中,金属元素的化合价为 。
③在化学反应中,11号元素的原子易 电子。
(2)如图是氢气在氯气中燃烧生成氯化氢的微粒示意图。
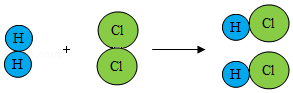
请据图回答:
①氢气可压缩储存于钢瓶中,因为受压时氢气分子之间的 减小。
②从微观的角度解释该化学变化的实质是 。
请你铵要求回答下列问题:
(1)阜新"宝地斯帕温泉"远近闻名。若要检验温泉水是硬水还是软水,可加入 检验。
(2)电解水的实验证明了水的组成。电解水的化学方程式为 。
(3)在做"细铁丝在盛有氧气的集气瓶中燃烧"的实验时,常常要在集气瓶里预先加少量的水,这样做的目的是 。
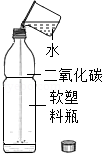
(4)为了设计实验证明二氧化碳能溶于水,某同学做了如图所示实验,该实验的现象是 。
(5)某纯净物X在空气中完全燃烧,反应的化学方程式为:X+2O 2  CO 2+2H 2O,则X的化学式为 。
CO 2+2H 2O,则X的化学式为 。
(6)氯化钠是食盐的主要成分,氯化钠的用途很多。例如,生活中的氯化钠是常用的调味品。此外,还可以利用氯化钠 等。