食盐中含有一定量的镁、铁等杂质,加碘盐中碘的损失主要是由于杂质、水分、空气中的氧气以及光照、受热而引起的。已知:氧化性:IO3->Fe3+>I2;还原性:S2O32->I-
3I2+6OH-=5I-+IO3-+3H2O KI+I2 KI3
KI3
(1)某学习小组对加碘盐进行了如下实验:取一定量某加碘盐(可能含有KIO3、KI、Mg2+、Fe3+),用适量蒸馏水溶解,并加稀盐酸酸化,将所得试液分为3份。第一份试液中滴加KSCN溶液后显红色;第二份试液中加足量KI固体,溶液显淡黄色,用CCl4萃取,下层溶液显紫红色;第三份试液中加入适量KIO3固体后,滴加淀粉试剂,溶液不变色。
①加KSCN溶液显红色,该红色物质是 (用化学式表示);CCl4中显紫红色的物质是 。
②第二份试液中加入足量KI固体后,反应的离子方程式为 、 。
(2)KI作为加碘剂的食盐在保存过程中,由于空气中氧气的作用,容易引起碘的损失。写出潮湿环境中KI与氧气反应的化学方程式: 。
将I2溶于KI溶液,在低温条件下,可制得KI3·H2O。该物质作为食盐加碘剂是否合适? (填“是”或“否”),并说明理由: 。
(3)为了提高加碘盐(添加KI)的稳定性,可加稳定剂减少碘的损失。下列物质中有可能作为稳定剂的是 。
| A.Na2S2O3 | B.AlCl3 | C.Na2CO3 | D.NaNO2 |
(4)对含Fe2+较多的食盐(假设不含Fe3+),可选用KI作为加碘剂。请设计实验方案,检验该加碘盐中的Fe2+: 。
下表是元素周期表的一部分,针对表中用字母标出的元素,回答下列问题:
(除特别注明外,其它一律用化学式表示)
| A |
|||||||||||||||||
| W |
T |
M |
|||||||||||||||
| B |
D |
Z |
J |
L |
U |
V |
R |
||||||||||
| X |
E |
Y |
G |
Q |
|||||||||||||
(1)化学性质最不活泼的单质是 ,金属氢氧化物中碱性最强的是,
属于过渡元素的是 (填字母),J在周期表中的位置。
(2)A 分别和L、M、T形成的化合物稳定性强弱顺序 > > ,
L、U、V的最高价氧化物对应水化物的酸性强弱顺序 > > 。
(3)V、Q形成的简单阴离子还原性强弱顺序 > ,
D、M、U、V形成的简单离子半径大小顺序 > > > 。
(4)写出Z、B分别形成的最高价氧化物对应水化物相互反应的离子方程式:
。
(5)已知G为常见的红色金属单质,现取7.68g G和50 mL 的浓硝酸反应,当G反应完毕时,溶液体积基本不变,共收集到气体的体积是3.36 L(标准状况,不考虑N2O4),剩余溶液中c(H+)=" 2.2" mol/L,则原硝酸溶液的浓度为。
下图是一些常见单质、化合物之间的转化关系图。有些反应中的部分物质及反应条件被略去。A和B组成元素相同,在常温下都是无色液体。D和E的组成元素相同,且E为红棕色的气体。I和K的组成元素相同,I在常温下是无色有毒气体,
J是红棕色固体,G是目前用量最多、用途最广的金属单质。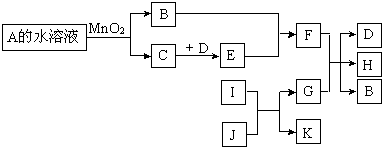
(1)A的化学式是。
(2)K的电子式是。
(3)请写出E和B反应的化学方程式。
(4)请写出G和足量的F稀溶液反应的离子方程式。
(5)常温下G(填“能”或“不能”)溶解于浓的F溶液中,原因是。
化学反应速率与生产、生活密切相关。
(1)某学生为了探究锌与盐酸反应过程中的速率变化,他在200mL稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气,实验记录如下(累计值):
| 时间(min) |
1 |
2 |
3 |
4 |
5 |
| 氢气体积(mL)(标准状况) |
50 |
120 |
232 |
288 |
310 |
①哪一时间段(指0~1、1~2、2~3、3~4、4~5 min)反应速率最小,
原因是。
②哪一时间段的反应速率最大,原因是。
③求3~4分钟时间段以盐酸的浓度变化来表示的该反应速率。
(设溶液体积不变)
④如果反应太激烈,为了减缓反应速率而又不减少产生氢气的量,他可采取的措施是:
A.加蒸馏水 B.加Na2CO3溶液 C.加NaCl溶液 D.加NaNO3溶液
(2)已知某温度时,在2L容器中X、Y、Z三种物质随时间的变化关系曲线如图所示。该反应的化学方程式为:。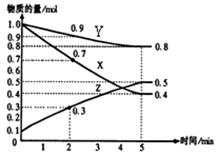
火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态双氧水。当它们混合反应时,即产生大量氮气和水蒸气,并放出大量的热。已知:0.8 mol液态肼与足量的液态双氧水反应,生成氮气和水蒸气,并放出513.2 kJ的热量。
(1) 反应的热化学方程式为
(2) 已知:H2O(1)=H2O(g)△H=" +44" kJ/mol,则16 g液态肼与液态双氧水反应生成液态水时放出的热量是;
(3) 此反应用于火箭推进,除释放大量热和快速产生大量气体外,还有一个很大的优点是。
(14分)某烃A是有机化学工业的基本原料,其产量可以用来衡量一个国家的石油化工发展水平,A还是一种植物生长调节剂,A可发生如图所示的一系列化学反应,其中①②③属于同种反应类型。根据如图回答下列问题: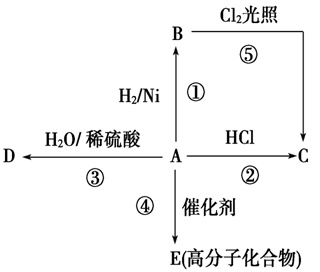
(1)写出A、D、E的结构简式:
A________________,D________________,E________________。
(2)写出②、⑤两步反应的化学方程式,并注明反应类型:
②____________________________,反应类型________。
⑤____________________________,反应类型________。