以下为中学化学中常见的物质:①Cu ②NaCl 固体 ③NaHSO4固体 ④SO3⑤稀 H2SO4⑥C2H5OH ⑦CaCO3固体 ⑧BaSO4固体 ⑨熔融 NaOH ⑩ 氨水 请按下列分类标准回答问题。(填写代号)
(1)能导电的是_________________________
(2)属于强电解质的是_________________________
(3)书写下列物质水溶液的电离方程式:
NaHSO4=_________________________
NaHCO3=_________________________
(4)书写NaOH溶液与少量 Ca(HCO3)2溶液反应的离子方程式:_________________________
海水是一个巨大的化学资源宝库,利用海水可以获得很多化工产品。
(1)海水中制得的氯化钠可用于生产烧碱及氯气。反应的离子方程式是。
(2)利用制盐后的盐卤提取溴的工艺流程如下(部分操作和条件已略去):
将Br2与Na2CO3反应的化学方程式补充完整:
(3)盐卤蒸发冷却后析出卤块的主要成分是MgCl2,此外还含Fe2+、Fe3+、Mn2+等离子。以卤块为原料制得镁的工艺流程如下(部分操作和条件已略去):
生成氢氧化物沉淀的pH
| 物质 |
开始沉淀 |
沉淀完全 |
| Fe(OH)3 |
2.7 |
3.7 |
| Fe(OH)2 |
7.6 |
9.6 |
| Mn(OH)2 |
8.3 |
9.8 |
| Mg(OH) 2 |
9.6 |
11.1 |
①步骤②中需控制pH=9.8,其目的是。
②用NaClO 氧化Fe2+得到Fe(OH)3沉淀的离子反应方程式是。
④步骤③需在HCl保护气中加热进行,请用化学平衡移动原理解释原因________。
③NaClO还能除去盐卤中的CO(NH2)2,生成盐和能参与大气循环的物质。除去0.1mol CO(NH2)2时消耗
NaClOg。
用CO2生产绿色燃料甲醇时发生反应A:CO2(g)+ 3H2(g) CH3OH(g) + H2O(g)
CH3OH(g) + H2O(g)
(1)2CH3OH(g) + 3O2 (g) ="==" 2CO2(g) + 4H2O(g) △H= -1365.0KJ/mol
H2(g) +1/2 O2 (g) ="==" H2O(g) △H=" -241.8" KJ/mol
CO2(g)+ 3H2(g) CH3OH(g) + H2O(g)的反应热△H=。
CH3OH(g) + H2O(g)的反应热△H=。
(2)在体积为1 L的恒容密闭容器中发生反应A,下图是在三种投料[n(CO2)和n(H2)分别为1mol,3mol;1mol,4mol和1mol,6mol]下,反应温度对CO2平衡转化率影响的曲线。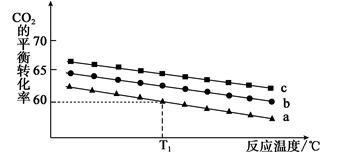
①曲线c对应的投料是。
②T1℃时,曲线a对应的化学平衡常数是。
③500℃时 ,反应A的平衡常数K=2.5,T1℃500℃(填“高于” 、“低于” 或“等于” )。
(3)甲醇/过氧化氢燃料电池的工作原理示意图如下: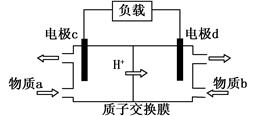
①d电极上发生的是(填“氧化”或“还原”)反应。
②物质b是(填化学式)。
③写出c电极的电极反应式。
氮的固定是几百年来科学家一直研究的课题。
(1)下表列举了不同温度下大气固氮和工业固氮的部分K值。
| 反应 |
大气固氮 N2 (g)+O2 (g) 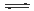 2NO(g) 2NO(g) |
工业固氮 N2 (g)+3H2 (g) 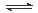 2NH3(g) 2NH3(g) |
|||
| 温度/℃ |
27 |
2000 |
25 |
400 |
450 |
| K |
3.84×10-31 |
0.1 |
5×108 |
0.507 |
0.152 |
①分析数据可知:大气固氮反应属于__________(填“吸热”或“放热”)反应。
②分析数据可知:人类不适合大规模模拟大气固氮的原因__________。
③从平衡视角考虑,工业固氮应该选择常温条件,但实际工业生产却选择500℃左右的高温,解释其原因_______________________。
|
(2)工业固氮反应中,在其他条件相同时,分别测定N2的平衡转化率在不同压强(р1、р2)下随温度变化的曲线,下图所示的图示中,正确的是________(填“A”或“B”);比较р1、р2的大小关系_________。


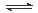 4NH3(g)+3O2(g),则其反应热ΔH=___________________。
4NH3(g)+3O2(g),则其反应热ΔH=___________________。
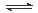 2NH3(g)△H=-92.4kJ·mol-1
2NH3(g)△H=-92.4kJ·mol-1
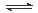 2H2O(l)△H=-571.6kJ·mol-1 )
2H2O(l)△H=-571.6kJ·mol-1 )
碳氧化物、氮氧化物、二氧化硫的处理与利用是世界各国研究的热点问题。
(1)消除汽车尾气中的NO、CO,有利于减少PM2.5的排放。已知如下信息:
I.
II.N2(g)+ O2(g)  2NO(g) ΔH1
2NO(g) ΔH1
2CO(g) + O2(g) 2CO2 (g)ΔH2=" -565" kJ·mol-1
2CO2 (g)ΔH2=" -565" kJ·mol-1
①ΔH1=。
②在催化剂作用下NO和CO转化为无毒气体,写出反应的热化学方程式
③一定条件下,单位时间内不同温度下测定的氮氧化物转化率如图1所示。
温度高于710K时,随温度的升高氮氧化物转化率降低的原因可能是
(2)测定汽车尾气常用的方法有两种。
①方法1:电化学气敏传感器法。其中CO传感器的工作原理如图2所示,则工作电极的反应式为
②方法2:氧化还原滴定法。用H2O2溶液吸收尾气,将氮氧化物转化为强酸,用酸碱中和滴定法测定强酸浓度。写出NO与H2O2溶液反应的离子方程式
(3)工业上可以用NaOH溶液或氨水吸收过量的SO2,分别生成NaHSO3、NH4HSO3,其水溶液均呈酸性。相同条件下,同浓度的两种酸式盐的水溶液中c(SO32-)较小的是,用文字和化学用语解释原因。
“低碳循环”引起各国的高度重视,而如何降低大气中CO2的含量及有效地开发利用CO2,引起了全世界的普遍重视。所以“低碳经济”正成为科学家研究的主要课题。
(1)已知:① CO(g)+H2O(g)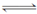 H2(g)+CO2(g) ΔH=-41 kJ·mol-1
H2(g)+CO2(g) ΔH=-41 kJ·mol-1
② C(s)+2H2(g)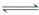 CH4(g) ΔH=-73 kJ·mol-1
CH4(g) ΔH=-73 kJ·mol-1
③ 2CO(g)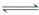 C(s)+CO2(g)ΔH=-171 kJ·mol-1
C(s)+CO2(g)ΔH=-171 kJ·mol-1
写出CO2与H2反应生成CH4和H2O(g)的热化学方程式。
(2)将燃煤废气中的CO2转化为二甲醚的反应原理为:2CO2(g)+6H2(g)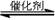 CH3OCH3(g)+3H2O(g)
CH3OCH3(g)+3H2O(g)
已知一定条件下,该反应中CO2的平衡转化率随温度、投料比[n(H2)/n(CO2)]的变化曲线如下左图: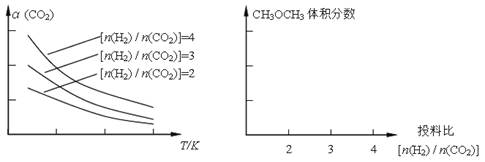
①在其他条件不变时,请在上图中画出平衡时CH3OCH3的体积分数随投料比[n(H2)/n(CO2)]变化的曲线图。
②某温度下,将2.0 mol CO2(g)和6.0 mol H2(g)充入容积为2L的密闭容器中,反应到达平衡时,改变压强和温度,平衡体系中CH3OCH3(g)的物质的量分数变化情况如下图所示,关于温度和压强的关系判断正确的是。
| A.P3>P2,T3>T2 | B.P1>P3,T1>T3 |
| C.P2>P4,T4>T2 | D.P1>P4,T2>T3 |
(3)煤化工通常通过研究不同温度下平衡常数以解决各种实际问题。已知等体积的CO和水蒸气进入反应器时,会发生如下反应:CO(g)+H2O(g)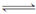 H2(g)+CO2(g),该反应平衡常数随温度的变化如下表所示:
H2(g)+CO2(g),该反应平衡常数随温度的变化如下表所示:
| 温度/℃ |
400 |
500 |
800 |
| 平衡常数K |
9.94 |
9 |
1 |
该反应的平衡常数的表达式为:
该反应的正反应方向是反应(填“吸热”或“放热”),若在500℃时进行,设起始时CO和H2O的浓度均为0.020 mol·L-1,在该条件下CO的平衡转化率为。