铁、铜混合粉末18.0g加入到100ml 5.0mol/LFeCl3溶液中,剩余固体质量为3.2g。下列说法正确的是
| A.剩余固体是铁、铜混合物 |
| B.反应后溶液中n(Fe2+)+ n(Cu2+)="0.75" mol |
| C.反应后溶液中n(Fe3+)="0.10" mol |
| D.原固体混合物中铜的质量是8.0g |
对某酸性溶液(可能含有Br-,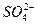 ,H2SO3,
,H2SO3,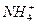 )分别进行如下实验:
)分别进行如下实验:
①加热时放出的气体可以使品红溶液褪色
②加碱调至碱性后,加热时放出的气体可以使润湿的红色石蕊试纸变蓝
③加入氯水时,溶液略显黄色,再加入BaCl2溶液,产生的白色沉淀不溶于稀硝酸
对于下列物质不能确认其在原溶液中是否存在的是()
| A.Br- | B.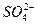 |
C.H2SO3 | D.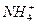 |
Cu2S与一定浓度的HNO3反应,生成Cu(NO3)2、CuSO4、NO2、NO和H2O,当NO2和NO的物质的量之比为1∶1时,实际参加反应的Cu2S与HNO3的物质的量之比为()
| A.1∶7 | B.1∶9 | C.1∶5 | D.2∶9 |
对于某些离子的检验及结论一定正确的是()
A.加入稀盐酸产生无色气体,将气体通入澄清石灰水中,溶液变浑浊,一定有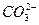 |
B.加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有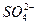 |
C.加入氢氧化钠溶液并加热,产生的气体能使湿润红色石蕊试纸变蓝,一定有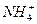 |
| D.加入碳酸钠溶液产生白色沉淀,再加盐酸白色沉淀消失,一定有Ba2+ |
在标准状况下,将O2与NO按3∶4的体积比充满一个干燥烧瓶,将烧瓶倒置于水中,瓶内液面逐渐上升后,最后烧瓶内溶液的物质的量浓度为()
| A.0.045 mol·L-1 | B.0.036 mol·L-1 | C.0.026 mol·L-1 | D.0.030 mol·L-1 |
如下图所示,夹子开始处于关闭状态,将液体A滴入试管②与气体B充分反应,打开夹子,可发现试管①内的水立刻沸腾了。则液体A和气体B的组合不可能是下列的()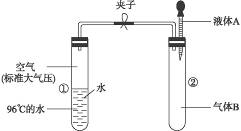
| A.氢氧化钠溶液、二氧化碳 | B.水、氨气 |
| C.氢氧化钠溶液、一氧化氮 | D.水、二氧化氮 |