铜是与人类关系非常密切的常见金属。
Ⅰ.已知常温下,在溶液中Cu2+稳定,Cu+易在酸性条件下发生反应:2Cu+ = Cu2++ Cu。
(1)CuH中H元素化合价为 。
(2)目前制备纳米级Cu2O的一种方法:在氢氧化铜悬浊液中滴入N2H4·H2O水溶液,充分反应后即可得到Cu2O,同时产生无色无味的气体。上述制备过程中总反应的化学方程式为 。
(3)一定条件下,在CuSO4中加入NH4H反应生成氢化亚铜(CuH)。将CuH溶解在足量稀硫酸中,当产生6.72 L H2(标准状况下)时,参加反应的硫酸的物质的量为 。
Ⅱ.孔雀石呈绿色,是一种名贵的宝石。其主要成分是xCu(OH)2·yCuCO3。某兴趣小组为探究孔雀石组成,利用下图所示的装置(夹持仪器省略)进行实验:

步骤1:检查装置的气密性,将研细的样品置于硬质玻璃管中。
步骤2:称量相关装置的质量,打开活塞K,鼓入空气,一段时间后关闭。
步骤3:加热装置B直至装置C中无气泡产生。
步骤4:_________________________。
步骤5:冷却至室温,称量相关装置的质量。
(1)请补充步骤4操作内容:_____________________________。
(2)若无装置E,则实验测定的x/y的值将__________(选填“偏大”、“偏小”或“无影响”)。
(3)某同学在实验过程中采集了如下数据:
| A.反应前硬质玻璃管与样品的质量163.8g |
| B.反应后硬质玻璃管中残留固体质量20g |
| C.装置C实验后增重2.25g |
| D.装置D实验后增重5.5g |
为测定x/y的值,你认为可以选用上述所采集数据中的_______________(写出所有组合的字母代号)任一组即可进行计算,并根据你的计算结果,写出孔雀石组成的化学式____________。
某地的酸雨中,含c(Na+)=7.0×10-6 mol·L-1,c(Cl-)=4.5×10-5 mol·L-1,c(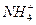 )=2.3×10-5 mol·L-1,c(
)=2.3×10-5 mol·L-1,c(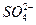 )=2.5×10-6 mol·L-1,则该地酸雨的pH约为。
)=2.5×10-6 mol·L-1,则该地酸雨的pH约为。
设水的电离平衡线如图3-4所示:(1)若以A点表示20 ℃时水在电离平衡时的离子浓度,当温度上升到100 ℃时,水的电离平衡状态到B点。则此时水的离子积______从增大到______。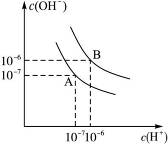
图3-4
(2)将100 ℃时pH=8的Ba(OH)2溶液与pH=5的稀H2SO4混合,并保持100 ℃的恒温。欲使混合液的pH=7,则Ba(OH)2与稀H2SO4的体积比为(二者混合后体积假设为二者体积之和)。
常温下,有pH=12的NaOH溶液100 mL,若将其pH变为11(溶液混合造成的体积变化忽略不计,计算结果保留小数点后一位)。
(1)若用pH=10的NaOH溶液,应加入 mL。
(2)若用pH=2的盐酸,应加入mL。
(3)若用0.01 mol·L-1的CH3COOH溶液V1 mL,则V1的取值范围为__________。
(4)若用pH=2的任意一元弱酸HR溶液V2 mL,则V2的取值范围为_________。
某温度下,纯水中由H2O电离出的c(H+)=2×10-7mol·L-1,则此时H2O电离出的c(OH-)=__________mol·L-1,该温度下,浓度为0.01 mol·L-1的NaOH溶液的pH=__________。
在25 ℃时,有pH=a(a≤6)的盐酸Va L和pH=b(b≥8)的NaOH溶液Vb L。二者混合恰好完全中和。问:
(1)若a+b=14时,则 =_________(填数值);
=_________(填数值);
(2)若a+b=13时,则 =_________(填数值);
=_________(填数值);
(3)若a+b>14时,则 =_________(填表达式),且VaVb(填“>”“<”或“=”)。
=_________(填表达式),且VaVb(填“>”“<”或“=”)。