[化学——选修3:物质结构与性质]
下图分别是金刚石、石墨、足球烯和碳纳米管的结构示意图。图中小黑点或小黑圈均代表碳原子。
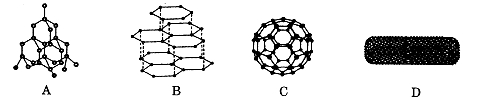
(1)四种物质互称为 。写出碳原子的基态电子排布图 。
(2)试比较:第一电离能I1(C)、I1(N)、I1(O)由大到小的顺序为 。
(3)石墨中存在的作用力有 。
A. 共价键 B. 金属键 C. 氢键
D. 配位键 E. 分子间作用力
石墨中碳原子采取的杂化方式是 。
(4)C的熔沸点比A (填“高”或“低”)原因是 。
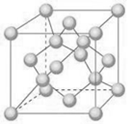
(5)金刚石晶胞结构如下图所示,若金刚石的密度为ρ g·cm-3,试计算碳原子的半径为 pm(用含ρ式子表示,不必化简)。
滚摆从图中的位置 1 静止释放,下降经过位置 2,继续下降,再上升到达最高点 3,这三个位置,滚摆重力势能最大的是____、动能为零的是_____、机械能最大的是_____(填写位置序号)
如图所示,电源电压恒定,当开关S1闭合、S2断开时,电压表的示数为3 V;当S1断开、S2闭合时,电压表的示数为4.5 V,则灯L1两端的电压为________ V,灯L2两端电压为________ V。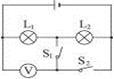
如图为旋转式变阻器的结构图,a、b、c为变阻器的三个接线柱,d为旋钮触片.将该变阻器接入电路中调节灯泡的亮度,当顺时针旋转旋钮触片时,灯泡变亮,则应该连接接线柱 (选填“a、b”“b、c”或“a、c”)和灯泡 联后接入电路中。
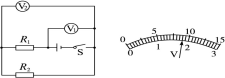
如图所示的电路,当开关S闭合后,若电阻R1、R2并联,则甲表是 表,乙表是 表。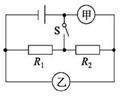
在如图所示电路中,当闭合开关后,两个电压表指针偏转均为如图所示,则电阻R1和R2两端的电压分别为________V和______V。