某晶体(结晶水合物)由五种短周期元素组成。常温下,将该晶体溶于蒸馏水后可电离出三种离子(忽略水的电离),其中两种离子含有的电子数均为10个。将该溶液分成等量2份,一份中加入足量稀盐酸,无明显现象,再加入BaCl2溶液,产生白色沉淀;向另一份中逐滴加入NaOH溶液至过量,生成沉淀的物质的量与加入NaOH溶液的体积关系如下图所示。
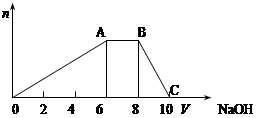
请回答下列问题:
(1)若该晶体的摩尔质量为906g·mol-1,写出该晶体的化学式 ;
(2)B点溶液的pH 7(填“<”、“>”或“=”),用化学用语表示其原因 。
(3)若向该晶体的水溶液中逐滴加入Ba(OH)2溶液至产生最多的沉淀,写出该变化的离子方程式 。
(4)C点溶液中所含溶质的化学式为 ;此时溶液中各种离子浓度由大到小顺序为 。
画出下列短周期元素的原子结构示意图:
(1)质量数为23,中子数为12的原子
(2)最外层电子数是次外层电子数3倍的原子
发生化学反应时,破坏化学键需要能量,形成化学键需要能量。吸收能量用E1表示,释放能量用E2表示,当E1E2时,反应吸收能量;当E1E2时,反应释放能量
工业上以粗铜为原料采取如图所示流程制备硝酸铜晶体: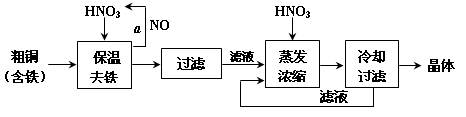
(1)在步骤a中,还需要通入氧气和水,发生反应的化学方程式是
。
(2)在保温去铁的过程中,为使Fe3+沉淀完全,可以向溶液中加入CuO,调节溶液的pH,根据下表数据,溶液的pH应保持在范围。若调节溶液的pH=4,此时,溶液中c (Fe3+) =。[已知该条件下,Fe(OH)3的KSP= 4.0×10-36 ]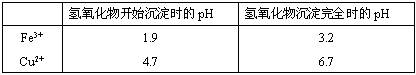
(3)不用加水的方法调节溶液pH的原因是。
(4)进行蒸发浓缩时,要加适量的硝酸以保持溶液一定的c(H+),其目的是(结合离子方程式简要说明)。
(5)工业上常利用硝酸铜溶液电镀铜,电镀时阴极的电极反应式是。
[化学——有机化学基础]
Ⅰ.对羟基肉桂酸是一种强效的导电材料,在液晶显示器工业中近年来研究广泛。结构简式如图。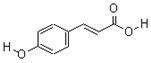
(1)该有机物具有的官能团名称是(写出其中的两种)。
(2)该有机物能发生的反应类型是(填写代号)。
A.氧化反应 B.消去反应 C.加聚反应 D.水解反应
Ⅱ.芳香族化合物C10H10O2有如下的转化关系: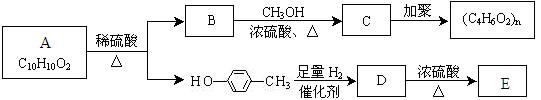
已知E能使Br2/CCl4溶液褪色。请回答下列问题:
(3)请分别写出A、E的结构简式A E。
(4)若有机物F与C互为同分异构体,则与有机物B为同系物的F的同分异构体有种
(5)请写出B→C反应的化学方程式。
[化学——物质结构与性质]
已知A、B、C、D、E五种元素的原子序数依次增大,其中A、E原子的最外层电子数均等于其周期序数,E原子的电子层数是A的3倍;B原子核外电子有6种不同的运动状态,S轨道电子数是P轨道电子数的两倍;D原子L层上有2对成对电子。请回答下列问题:
(1)E元素基态原子的电子排布式为。
(2)B、C、D三种元素的第一电离能数值由小到大的顺序为(填元素符号)。
(3)D元素与氟元素相比,电负性:DF(填“>”、“=”或“<”)。
(4)BD2在高温高压下所形成的晶体其晶胞如图所示。该晶体的类型属于(选填“分子”、“原子”、“离子”或“金属”)晶体,该晶体中B原子轨道的杂化类型为。l mol B2A2分子中含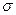 键的数目是。
键的数目是。
(5)光谱证实单质E与强碱溶液反应有[E(OH)4]—生成,则[E(OH)4]—中存在。
a.共价键 b.配位键 c.σ键 d.π键