(1)已知反应A放出热量Q1kJ,焓变为△H1,反应B放出热量Q2kJ,焓变为△H2,若Q1> Q2,则△H1 △H2
(2)1molC与1molH2O(g)反应生成1molCO(g)和1molH2(g),需吸收131.5kJ的热量,该反应的反应热为△H= kJ/mol;
(3)反应A+3B=2C+2D在四种不同情况下的反应速率分别为:

该反应进行快慢的顺序为
(4)、火箭发射时可用肼(N2H4)作燃料,二氧化氮作氧化剂,这两者反应生成氮气和水蒸汽。已知:
N2(g)+2O2(g)==2NO2(g) △H= + 67.7KJ・mol-1
N2H4 (g)+O2(g)="=" N2(g)+ 2H2O(g) △H= -534KJ・mol-1
则1mol气体肼和NO2完全反应时的反应热△H=
(8分)在2 L密闭容器内,800 ℃时反应2NO(g)+O2(g)  2NO2(g)(正反应为放热反应)体系中,n(NO)随时间的变化如下表:
2NO2(g)(正反应为放热反应)体系中,n(NO)随时间的变化如下表:
| 时间(s) |
0 |
1 |
2 |
3 |
4 |
5 |
| n(NO)(mol) |
0.020 |
0.010 |
0.008 |
0.007 |
0.007 |
0.007 |
(1)如图中表示NO2变化曲线的是 。用O2表示从0 s~2 内该反应的平均速率v= mol/(L·s)。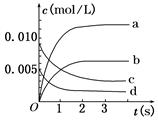
(2)能说明该反应已达到平衡状态的是 .
a.v(NO2)=2v(O2) b.容器内压强保持不变
c.v(NO)逆=2v(O2)正 d.容器内密度保持不变
(3)能使该反应的反应速率增大,且平衡向正反应方向移动的是
a.及时分离出NO2气体 b.适当升高温度
c.增大O2的浓度 d.选择高效催化剂
某化学反应的反应物和产物如下:Al+NaNO3+H2O→Al(OH)3+N2+NaAlO2
(1)该反应的氧化剂是_____________。
(2)该反应的氧化产物是______________。
(3)反应过程中转移5 mol e-,生成标准状况下N2的体积__________ L。
(4)配平该反应的化学方程式:___Al+____NaNO3+___H2O=______Al(OH)3+____N2+___NaAlO2。
下图中的每一方格表示有关的一种反应物或生成物,其中甲、乙、丙、丁为常见单质,其余均为化合物,A是一种常见的液态化合物,B是具有磁性的氧化物,D和丁既能和酸反应又能和碱反应,乙在丙中燃烧产生苍白色火焰,它们的转化关系如下:(有些反应的条件和部分产物未注明)
(1)上述反应中属于氧化还原反应的是(填写序号);
(2)写出下列物质化学式:B,D,F;
(3)写出反应的化学方程式:A+甲;
(4)H在空气中很容易被氧化成I,该过程的实验现象是;将足量的CO2通入E溶液中,离子方程式是。
钠的化合物在生产和生活中起到重要的作用。请回答下列问题:
(1)碳酸氢钠俗称,水溶液呈性。碳酸氢钠粉末可用于治疗胃酸(0.2%-0.4%的盐酸)过多,反应的离子方程式是;
(2)除去NaHCO3溶液中少量的Na2CO3溶液,(填“能”或“不能”)用足量的澄清石灰水,原因是_______________用离子方程式表示);等质量的碳酸钠和碳酸氢钠分别与足量稀盐酸反应产生气体的物质的量之比;
(3)过氧化钠可用于呼吸面具或潜水艇中氧气的来源,写出化学反应方程式,并用双线桥法标电子转移的方向和数目;若有5. 6L水蒸气通过一 定质量的过氧化钠粉末后,气体体积减小到4.48 L,则气体的成分是,气体的总质量是。(气体体积已折算成标准状况)
信息时代产生的大量电子垃圾对环境构成严重威胁。某研究性学习小组将一批废弃的线路板简单处理后,得到含Cu、Fe及少量Au、Pt等金属的混合物,并用如下流程制备胆矾晶体(CuSO4•5H2O):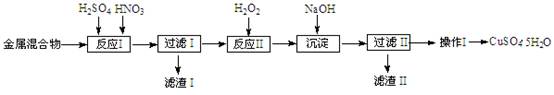
已知:部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 阳离子 |
Fe3+ |
Fe2+ |
Cu2+ |
| 开始沉淀 |
1.5 |
6.4 |
4.2 |
| 完全沉淀 |
3.2 |
8.9 |
6.7 |
(1)滤渣Ⅰ的主要成份是(写化学式)______。
(2)反应Ⅱ中加入H2O2的作用是______。
(3)沉淀过程中发生反应的离子方程式有______、______。
(4)操作Ⅰ的步骤是______、______、过滤、洗涤、干燥。
(5)测定胆矾晶体纯度的实验步骤如下:
a. 准确称取3.125g胆矾晶体样品配成100mL溶液;
b. 取10.00 mL溶液于带塞锥形瓶中,加适量水稀释,加入过量KI固体,发生反应:
2Cu2+ +4Iˉ=2CuI↓ + I2
c. 继续向上述混合物中,逐滴加入0.1000 mol·L-1Na2S2O3溶液至恰好完全反应,共消耗12. 00mL Na2S2O3溶液:I2+2S2O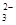 = 2Iˉ+S4O
= 2Iˉ+S4O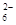
求样品中胆矾晶体的质量分数(写出计算过程)。