下列大小比较正确的是
| A.稳定性:HI>HBr>HCl>HF | B.元素非金属性:Si>P>S>Cl |
| C.沸点: 正丁烷>异丁烷>丙烷 | D.碱性NaOH>KOH>Ca(OH)2>Ba(OH)2 |
Al、Fe、Cu都是重要的金属元素。下列说法正确的是
| A.制备AlCl3、FeCl3、CuCl2均不能采用将溶液直接蒸干的方法 |
| B.三者的单质放置在空气中均只生成氧化物 |
| C.工业上,三者的单质目前都使用热还原法制得 |
| D.电解AlCl3、FeCl3、CuCl2的混合溶液时阴极上依次析出Cu、Fe、Al |
NA代表阿伏加德罗常数,下列有关叙述错误的是
| A.1mol 固体NaHSO4含有的阴阳离子总数为2NA |
| B.标准状况下22.4L CH4和C2H4的混合气体所含氢原子数为4NA |
| C.常温常压下,3.4gNH3中含N—H键数目为0.6NA |
| D.56 g铁粉在1mol氯气中充分燃烧,失去的电子数为3NA |
下列有关化学用语的表示正确的是
A.N2的电子式: |
B.CH4的比例模型: |
| C.中子数为45的溴原子:45 35Br |
D.对羟基苯甲酸的结构简式: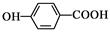 |
天然碱的组成可以用aNa2CO3·bNaHCO3·cH2O(a、b、c为整数)表示。通过以下实验测定某天然碱的化学式,将质量为12.45 g的某天然碱溶于水,逐滴滴加某浓度的稀盐酸,产生气体的体积与加入盐酸的体积(标准状况)的关系如下表所示:
| 盐酸体积(mL) |
20 |
40 |
60 |
80 |
| 产生气体体积(mL) |
0 |
560 |
1680 |
2520 |
下列说法错误的是
A.加入盐酸体积小于20 mL时,体系发生的离子反应为: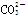 +H+===
+H+===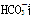
B.加入盐酸体积为50 mL时,产生气体(标准状况)的体积为1120mL
C.本实验使用盐酸的浓度为2.5 mol·L-1
D.该天然碱的化学式为Na2CO3·2NaHCO3·2H2O
室温下,在0.2 mol·L-1 Al2(SO4)3,溶液中,逐滴加入1.0 mol·L-1 NaOH溶液,实验测得溶液pH随NaOH溶液体积变化曲线如图,下列有关说法正确的是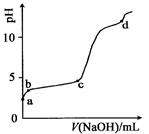
A.a点时,溶液呈酸性的原因是Al3+水解,离子方程式为:Al3++3OH- Al(OH)3 Al(OH)3 |
| B.a~b段,溶液pH增大,Al3+浓度不变 |
| C.b~c段,加入的OH-主要用于生成Al(OH)3沉淀 |
| D.d点时,Al(OH)3沉淀开始溶解 |