I、标准状况下,1体积水中能溶解500体积的HCl气体。若向水中通入标准状况下的44.8LHCl气体配成1L溶液,假设气体完全溶解。请回答:
(1)所得溶液中含HCl的物质的量浓度为 ;
(2)从该溶液中取出10mL溶解于水配制成250mL溶液,配制后的稀溶液中含HCl物质的量浓度为 。
(3)配制过程中,造成浓度偏低的操作可能有_______________(选填下列操作的序号)。
| A.容量瓶用蒸馏水洗后未干燥 |
| B.量筒用蒸馏水洗后未干燥 |
| C.将烧杯中浓盐酸移入容量瓶后,未用水洗涤烧杯,即向容量中加水到刻度 |
| D.用胶头滴管向容量瓶中加水时,不慎超过刻度线,用另外胶头滴管从瓶中吸出部分溶液使剩余溶液刚巧达刻度线 |
E、定容时,俯视液面加水至刻度线
II.实验室欲用NaOH固体配制所需的480mL 1.0mol/L的NaOH溶液:
(1)配制时,必须使用的玻璃仪器有________、________、________、________。
(2)要完成本实验该同学应称出NaOH________g。
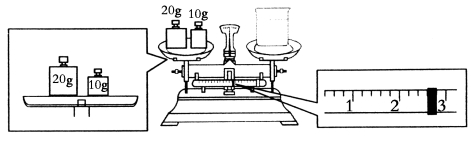
(3)某同学欲称量NaOH的质量,他先用托盘天平称量烧杯的质量,天平平衡后的状态如图,烧杯的实际质量为________g。
(4)使用容量瓶前必须进行的一步操作是________。
(14分) 为解决大气中CO2的含量增大的问题,某科学家提出“绿色自由”构想:把工厂排出的富含CO2的废气经净化吹入碳酸钾溶液吸收,然后再把CO2从溶液中提取出来,经化学反应使废气中的CO2转变为燃料甲醇。“绿色自由”构想的部分技术流程如下: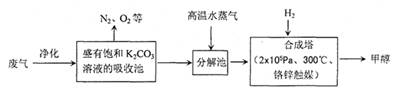
(1)合成塔中反应的化学方程式为;△H<0。该反应为可逆反应,从平衡移动原理分析,低温有利于提高原料气的平衡转化率。而实际生产中采用300℃的温度,除考虑温度对反应速率的影响外,还主要考虑了。
(2)从合成塔分离出甲醇的原理与下列操作的原理比较相符(填字母)
A.过滤 B.分液 C.蒸馏 D.结晶
工业流程中一定包括“循环利用”,“循环利用”是提高效益、节能环保的重要措施。“绿色自由”构想技术流程中能够“循环利用”的,除K2CO3溶液和CO2、H2外,还包括。
(3)一定条件下,向体积为1 L的密闭容器中充入1 mol CO2和3 mol H2,测得CO2和CH3OH(g)的浓度随时间变化曲线如图所示。下列叙述中,正确的是。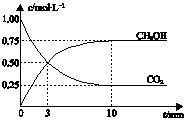
A.升高温度能使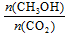 增大
增大
B.反应达到平衡状态时,CO2的平衡转化率为75%
C.3 min时,用CO2的浓度表示的正反应速率等于用CH3OH的浓度表示的逆反应速率
D.从反应开始到平衡,H2的平均反应速率υ(H2)=0.075 mol?L-1?min-1
(4) 如将CO2与H2以1:4的体积比混合,在适当的条件下可制得CH4。
巳知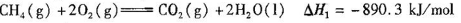

写出C02(g)与H2(g)反应生成CH4(g)与液态水的热化学方程式
___________ _____。
(12分) 实验室中以铝土矿(主要成分是Al2O3和少量的SiO2和Fe2O3杂质)为原料制取Al2(SO4)3和铵明矾晶体[NH4Al(SO4)2·12H2O]的工艺流程如下:
试回答下列问题:
⑴固体a的化学式为_____,III中通入过量CO2气体的离子方程式为。
⑵由V制取铵明矾溶液的化学方程式为__________________________,从铵明矾溶液中获得铵明矾晶体的实验操作依次为(填操作名称)、冷却结晶、过滤洗涤。
⑶以1000kg含氧化铝36%的铝土矿为原料制取Al2(SO4)3,需消耗质量分数98%的硫酸(密度1.84g/cm3)___________L(保留一位小数)。
⑷若同时制取铵明矾和硫酸铝,通过控制硫酸的用量调节两种产品的产量。若欲使制得的铵明矾和硫酸铝的物质的量之比为1:1,则投料时铝土矿中Al2O3和H2SO4的物质的量之比为___________。
(15分)敌草胺是一种除草剂。它的合成路线如下: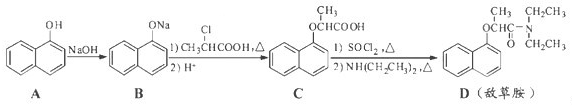
回答下列问题:
(1)在空气中久置,A易被空气中O2氧化而由无色转变为棕色,这与下列物质中的(填序号)的性质类似。
A.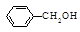 |
B. |
C. |
D. |
(2)C分子中有2个含氧官能团,分别为和(填官能团名称)。
(3)由B与CH3CHClCOOH转化成C时,从结构上看,还有另一种无机物生成,则该无机物是。
(4)若C不经提纯,产物敌草胺中将混有少量副产物E,E是一种由B和C生成的酯(变化过程中碳原子数未变),推断E的分子式为。
(5)已知: ,若以苯酚和乙酸为原料制备
,若以苯酚和乙酸为原料制备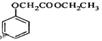 ,其合成路线中应分为步变化。
,其合成路线中应分为步变化。
工业上生产高氯酸(沸点:90oC)时还同时生产了亚氯酸钠,其工艺流程如下: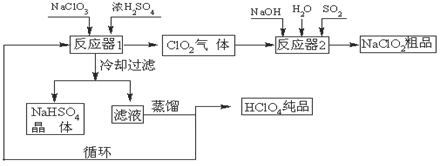
(1)冷却过滤的目的是降低NaHSO4的并分离出NaHSO4晶体。
(2)反应器2中发生反应的离子方程式为。SO2的作用是作剂。
(3)循环使用的物质是。
(4)可以通过蒸馏滤液的方法得到高氯酸的原因可能是。
(5)工业上用铂作阳极、铜或银作阴极电解盐酸也可制得高氯酸,在阳极区可得到20%的高氯酸。写出阳极的电极反应式(其中盐酸与高氯酸以化学式出现)。
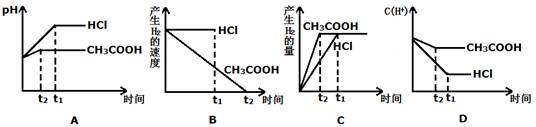
(I)在甲烧杯中放入盐酸,乙烧杯中放入醋酸,两种溶液的体积和pH都相等,向两烧杯中同时加入质量不等的锌粒,反应结束后得到等量的氢气;则
(1)烧杯中放入锌的质量大(填“甲”或“乙”);
(2)烧杯中的酸过量(填“甲”或“乙”);
(3)反应开始后乙烧杯中的c(H+)始终比甲烧杯中的c(H+)(填“大”或“小”)。
(II)物质的量浓度相同的等体积的两份溶液A和B,A为盐酸,B为醋酸,分别和等质量的Zn反应,则下列说法正确的是:
①产生的H2质量一定相同 ②产生H2的质量一定不同
③仅有一份溶液中存在锌,则一定是盐酸④等倍数稀释后的反应速率A>B
⑤产生等量H2所需时间A>B⑥产生等量H2,盐酸和醋酸一定都有剩余
(III)向体积都为1L,pH都等于2的盐酸和醋酸溶液中投入0.3g Zn,则下图中比较符合客观事实的曲线是。