(每空2分,共8分)研究硫及其化合物性质有重要意义。
(1)Cu2S在高温条件下发生如下反应:2Cu2S(s)+3O2(g)=2Cu2O(s)+2SO2(g) ⊿H=-773kJ/mol,当该反应有0.2mol SO2生成时,反应释放出的热量为___________kJ。
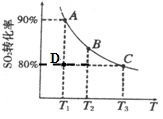
(2)硫酸工业生产中涉及如下反应:2SO2(g)+O2(g) 2SO3(g)。向2L的容器中充入2molSO2、1molO2,SO2的平衡转化率与温度的关系如图所示。T1温度时反应进行到状态D时,v(正) v(逆)(填“>”、“<”或“=”)。温度为T1时,反应的平衡常数K= 。若在T3温度时,达平衡时测得反应放出的热量为Q1。此时再向容器中加入2molSO2、1molO2并使之重新达到平衡,测得又放出热量Q2。则下列说法正确的是 。(填字母编号)
2SO3(g)。向2L的容器中充入2molSO2、1molO2,SO2的平衡转化率与温度的关系如图所示。T1温度时反应进行到状态D时,v(正) v(逆)(填“>”、“<”或“=”)。温度为T1时,反应的平衡常数K= 。若在T3温度时,达平衡时测得反应放出的热量为Q1。此时再向容器中加入2molSO2、1molO2并使之重新达到平衡,测得又放出热量Q2。则下列说法正确的是 。(填字母编号)
a.容器的压强增大原来的两倍
b.Q2一定等于Q1
c.新平衡时SO2的转化率一定大于80%
d.T3时的平衡常数大于T1时的平衡常数
我们的生活、学习离不开物质,其中很多物质是通过工业生产而得到的。请回答下列问题:
(1)生活用水是来自于自来水公司的管道水,其来源有两个:地表水和地下水。地表水中往往含有悬浮物和胶体,自来水厂需要对地表水进行________处理;地下水中往往含有钙、镁的碳酸盐,自来水厂需要对地下水进行__________处理。
(2)有限的土地,要提高粮食产量,离不开科学技术,离不开化学肥料的合理使用。铵态氮肥中的“铵”的生产原料为________,该物质在工业生产中使用的条件是__________________________________。
(3)患有近视的同学学习离不开眼镜,眼镜片有玻璃和合成树脂的。其中易碎的镜片材料是__________,镜片有灰尘不能用酒精擦拭的是__________。
(4)厨房中离不开食盐,该物质主要来自于海水,写出一种用海水制备食盐的方法____________,工业上可用食盐制备纯碱,食盐的作用是________________________。
将磷肥生产中形成的副产物石膏(CaSO4·2H2O)转化为硫酸钾肥料和氯化钙水合物储热材料,无论从经济效益、资源综合利用还是从环境保护角度看都具有重要意义。以下是石膏转化为硫酸钾和氯化钙的工艺流程示意图。
(1)本工艺中所用的原料除CaSO4·2H2O、KCl外,还需要__________等原料。
(2)写出石膏悬浊液中加入碳酸铵溶液后发生反应的离子方程式: ______________________。
(3)过滤Ⅰ操作所得固体中,除CaCO3外还含有____________(填化学式)等物质,该固体可用作生产水泥的原料。
(4)氯化钙结晶水合物(CaCl2·6H2O)是目前常用的无机储热材料,选择的依据是__________。
a.熔点较低(29 ℃熔化) b.能导电
c.能制冷d.无毒
(5)上述工艺流程中体现的绿色化学理念是____________________________
材料一 DDT是20世纪60年代以前广为应用的一种杀虫剂,它由三氯乙醛和氯苯通过如下反应制备得到: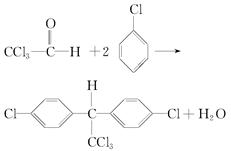
据统计,由于使用了DDT等化学农药,减少了病虫害,挽回的粮食损失占总产量的15%。若以世界粮食产量18亿吨计算,那么有2.7亿吨是由化学农药换回来的,相当于10多亿人一年的口粮。此外,DDT还能有效地杀灭蚊蝇、体虱等传播疾病的害虫,从而大大减少疟疾、伤寒等的发病率和死亡人数。瑞士昆虫学家保罗·米勒因发现DDT药效,而于1948年荣获诺贝尔生理医学奖。
材料二 DDT曾因其稳定性、脂溶性、药效普适性等特点被大量生产和普遍使用,以致造成很大的环境污染。美国生物学家卡尔松曾对包括DDT在内的医药所造成的公害,做过生动的描写:“天空无飞鸟,河中无鱼虾,成群鸡鸭牛羊病倒和死亡,果树开花但不能结果,农夫诉说着莫名其妙的疾病接踵袭来。总之,生机勃勃的田野和农庄变得一片寂静,死亡之幽灵到处游荡……”此发现引起社会强烈反响。从20世纪70年代初起,美国、瑞士等国相继禁止生产DDT。我国政府于1985年禁止使用DDT。
材料三 为了杀灭对人类有害的昆虫,而又避免或减少污染环境和破坏生态平衡。化学工作者进行了不懈地努力,研制出多种新型杀虫剂,以代替DDT等农药。例如,化合物A就是其中一种,其结构简式如图所示。
请完成下列各题。
(1)氯苯是一种重要的化工原料,由氯苯和三氯乙醛生产DDT的反应是__________。
A.化合反应B.分解反应C.取代反应D.加成反应
(2)下列关于DDT的说法中,不正确的是__________。
A.DDT也能杀死有益的生物
B.DDT极易溶于水
C.DDT是烃的衍生物
D.DDT不易被生物分解
(3)在过去,施用农药DDT的地区虽然占陆地面积的一小部分,可是在远离施药地区的南极的动物体内也发现了DDT,在喜马拉雅山山峰的积雪中也发现了DDT,这种现象说明________。
A.DDT是挥发性物质
B.DDT已加入全球性的生物循环
C.考察队将DDT带到了南极
D.南极动物也偶尔到施用农药的地区觅食
(4)①化合物A的分子式为__________;
②化合物A可能有的化学性质________。
A.取代反应 B.加成反应 C.氧化反应 D.还原反应
E.酯化反应 F.水解反应
使用抗生素是治疗甲型H1N1流感的有效方法。青霉素的结构简式为: (R不同可形成不同的青霉素),本次治疗甲型H1N1流感,使用的五种青霉素所对应R的结构简式如下:
(R不同可形成不同的青霉素),本次治疗甲型H1N1流感,使用的五种青霉素所对应R的结构简式如下:
| 青霉素 |
—R |
| A |
CH3CH2CH=CHCH2CH2— |
| B |
 |
| C |
CH3—(CH2)4— |
| D |
CH3CH=CH—C(CH3)2— |
| E |
CH3—(CH2)6— |
根据表中五种青霉素回答下列问题:
(1)青霉素E的分子式________。
(2)属于同分异构体的是________,属于同系物的是________。
(3)已知蛋白质在酸性或碱性条件下都能水解,青霉素D分别与足量的盐酸和NaOH溶液反应,消耗HCl和NaOH的物质的量之比为________。
(4)青霉素A、B中的—R连接得到有机物F。对该有机物F的说法中不正确的是( )。
A.该有机物能使溴水和酸性KMnO4溶液褪色
B.该有机物可在一定条件下生成醇类
C.该有机物燃烧一定生成CO2和H2O
D.1 mol该有机物最多能与4 mol H2发生加成反应
精细化学品具有品种多、批量少、产值高的特点。
(1)表面活性剂在工农业生产和日常生活中广泛应用,其优点是______________,能显著降低水与空气或其他物质的________,提高工业生产________,提高产品的________,故表面活性剂被称为_________________。
(2)在泡沫灭火器中添加表面活性剂可以提高灭火效果的原因是什么?
(3)精细化学品具有特定的功能,特殊的用途,如有些洗衣粉适用于洗衣机,加酶洗衣粉不能用于洗涤____________,医药和农药都有严格的________、__________等。