根据表中信息判断,下列选项错误的是
| 序列 |
参加反应的物质 |
生成物 |
| ① |
KMnO4 、H2O2 、H2SO4 |
K2SO4 、MnSO4…… |
| ② |
Cl2 、FeBr2 |
FeCl3 、FeBr3 |
| ③ |
MnO4- …… |
Cl2 、Mn2+…… |
A.第①组反应的其余产物为H2O和 O2
B.第②组反应中Cl2 与 FeBr2的物质的量之比为1︰2
C.第③组反应中生成1mol Cl2,转移电子2mol
D.氧化性由强到弱顺序为MnO4-> Cl2 > Fe3+> Br2
人体血液里存在重要的酸碱平衡: ,使人体血液pH保持在7.35~7.45,否则就会发生酸中毒或碱中毒。其pH随c(HCO3-)∶c(H2CO3)变化关系如下表:
,使人体血液pH保持在7.35~7.45,否则就会发生酸中毒或碱中毒。其pH随c(HCO3-)∶c(H2CO3)变化关系如下表:
| c(HCO3-):c(H2CO3) |
1.0 |
17.8 |
20.0 |
22.4 |
| pH |
6.10 |
7.35 |
7.40 |
7.45 |
下列说法不正确的是()
A.正常人体血液中,HCO3-的水解程度大于电离程度
B.人体血液酸中毒时,可注射NaHCO3溶液缓解
C.pH=7.00的血液中,c(H2CO3)<c(HCO3-)
D.pH=7.40的血液中,HCO3-的水解程度一定大于H2CO3的电离程度
化工生产中含Cu2+的废水常用MnS(s)作沉淀剂,其反应原理为Cu2+(aq)+MnS(s)  CuS(s)+Mn2+(aq)。下列有关该反应的推理不正确的是()
CuS(s)+Mn2+(aq)。下列有关该反应的推理不正确的是()
| A.该反应达到平衡时:c(Cu2+)=c(Mn2+) |
| B.CuS的溶解度比MnS的溶解度小 |
| C.往平衡体系中加入少量Cu(NO3)2(s)后,c(Mn2+)变大 |
D.该反应平衡常数表达式:K=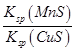 |
下列溶液中微粒浓度关系不正确的是()
| A.常温下,氨水与氯化铵的pH=7的混合溶液中:c(Cl-)=c(NH4+) |
| B.pH=1的一元酸和pH=13的一元碱等体积混合:c(OH-)=c(H+) |
| C.0.1 mol·L-1的硫酸铵溶液中:c(NH4+)>c(SO42-)>c(H+)>c(OH-) |
| D.0.1 mol·L-1的硫化钠溶液中:c(OH-)=c(H+)+c(HS-)+2c(H2S) |
下列关于常温下电解质溶液的叙述中,正确的是()
| A.碳酸氢铵溶液和足量氢氧化钠溶液混合的离子反应:HCO3-+OH-=CO32-+H2O |
| B.等物质的量浓度、等体积的氨水和盐酸混合后,c(H+)+c(NH4+)=c(Cl-)+c(OH-) |
| C.等物质的量浓度的NH4Cl溶液和NH3·H2O溶液,溶液中c(NH4+)前者小于后者 |
| D.25℃时,pH=8的0.1 mol·L-1NaX溶液中由水电离出的c(OH-)=1×10-8 mol·L-1 |
在T℃时,某NaOH稀溶液中c(H+)=10-a mol·L-1,c(OH-)=10-b mol·L-1,已知a+b=12。向该溶液中逐滴加入pH=c的盐酸(T℃),测得混合溶液的部分pH如下表所示:
| 序号 |
NaOH溶液体积 |
盐酸体积 |
溶液pH |
| ① |
20.00 |
0.00 |
8 |
| ② |
20.00 |
20.00 |
6 |
假设溶液混合前后的体积变化忽略不计,则c为()
A.1B.4 C.5D.6