氧化还原反应在生产、生活中应用广泛,酸性KMnO4、H2O2、Fe(NO3)3是重要的氧化剂.用所学知识回答问题:
(1)3H2SO4+2 KMnO4+5H2O2=K2SO4+2MnSO4+5 O2↑+8 H2O,当有6 mol H2SO4参加反应的过程中,有 mol还原剂被氧化。
(2)在稀硫酸中,KMnO4与H2C2O4反应的离子方程式为
(3)取300mL 0.2mol/L的KI溶液与一定量的酸性KMnO4溶液恰好反应,生成等物质的量的I2和KIO3,则消耗KMnO4的物质的量的是 mol。
(4)在Fe(NO3)3溶液中加入Na2SO3溶液,溶液先由棕黄色变为浅绿色,过一会又变为棕黄色,溶 液先变为浅绿色的离子方程式是 ,又变为棕黄色的原因是
欧盟定于2012年1月1日起征收航空碳排税以应对冰川融化和全球变暖,使得对如何降低大气中CO2的含量及有效地开发利用碳资源的研究显得更加紧迫。请运用化学反应原理的相关知识研究碳及其化合物的性质。
(1)焦炭可用于制取水煤气。测得12 g 碳与水蒸气完全反应生成水煤气时,吸收了131.6
kJ热量。该反应的热化学方程式: 。
(2)活性炭可处理大气污染物NO。在2 L密闭容器中加入NO和活性炭(无杂质),生成气体E和F。当温度分别在T1和T2时,测得各物质平衡时物质的量如下表:
 物质 物质T/℃ n/mol |
活性炭 |
NO |
E |
F |
| 初始 |
2.030 |
0.100 |
0 |
0 |
| T1 |
2.000 |
0.040 |
0.030 |
0.030 |
| T2 |
2.005 |
0.050 |
0.025 |
0.025 |
①写出NO与活性炭反应的化学方程式 。
②上述反应T1℃时的平衡常数为 K1,T2℃时的平衡常数为 K2。
Ⅰ.K1 = 。(列式并计算)
Ⅱ.根据上述信息判断,温度T1和T2的关系是(填序号) 。
a.T1>T2b.T1<T2 c.无法比较
(3)CO2经常用氢氧化钠溶液来吸收,现有0.4molCO2,若用200mL 3mol/L NaOH溶液将其完全吸收,溶液中离子浓度由大到小的顺序为: 。
(4)CO还可以用做燃料电池的燃料,某熔融盐燃料电池具有很高的发电效率,因而受到重视,该电池用 Li2CO3和 Na2CO3的熔融盐混合物作电解质,CO 为阳极燃气,空气与 CO2的混合气为阴极助燃气,制得在 650 ℃下工作的燃料电池,其阳极反应式:2CO-4e—+ 2CO32— =4CO2,则阴极反应式为: 。
(5)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其Ksp=3.8×10-9。CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为2×10-4mo1/L ,则生成沉淀所需CaCl2溶液的最小浓度为 。
草酸镍晶体(NiC2O4 . 2H2O)常用于制镍催化剂。工业上利用镍废渣(主要含镍,还含有Al2O3、Fe、SiO2、CaO等)提取草酸镍晶体的流程如下:
(1)镍废渣粉碎的目的为 。
(2)除铁时,控制不同的条件可以得到不同的滤渣2。已知滤渣2的成分与温度、PH的关系如图所示:
①若控制温度20℃、PH=5,则滤渣2的主要成分为 (填化学式)。
②若控制温度80℃、PH=4,写出该条件下发生反应的离子方程式: 。
(3)滤渣3的主要成分为 (填化学式)。
(4)沉镍时,判断Ni2+是否沉淀完全的方法是 。
(5)硫酸镍(NiSO4)用于化学镀镍时,常用甲醛做还原剂,若氧化产物为CO2,则氧化剂与还原剂的物质的量之比为 。
(6)实验:
I.称量28.7g镀镍试剂,配成100ml溶液;
II.准确量取10.00ml溶液,用0.40mol.l-1的EDTA(Na2H2Y2)标准溶液滴定其中的Ni2+
(离子方程式为Ni2++H2Y2-=NiY2-+2H+),消耗EDTA标准溶液25.00ml;
①配制100ml的镀镍试剂时,需要的仪器除托盘天平、玻璃棒、烧杯、量筒、胶头滴管外,还需要 。
②该镀镍试剂的化学式为 。
某溶液A中可能含有NH4+、Fe3+、Al3+、Fe2+、CO32-、NO3-、Cl-、SO42-中的几种离子,且溶液中各离子的物质的量浓度均为0.1mol.L-1。现取该溶液进行如下实验: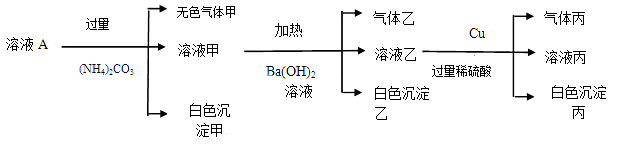
(1)溶液A中一定不存在的离子为 (填离子符号)。
(2)溶液A中加入(NH4)2CO3,生成白色沉淀甲和气体甲的原因是 。
(3)白色沉淀乙的成分为 (填化学式)。
(4)为了进一步确定溶液A中是否含有NH4+,另取10ml该溶液,向其中滴加NaOH溶液,沉淀的物质的量随NaOH溶液体积的变化如图所示。
据图回答:
①溶液A中 (填“含有”或“不含有”)NH4+
②所加NaOH溶液的物质的量浓度为 mol.L-1
③若在A溶液中改加10ml0.2mol.L-1Ba(OH)2溶液,充分反应后,溶液中产生沉淀的物质的量为 mol
运用元素周期律研究元素及其化合物的性质具有重要的意义。
I.部分短周期主族元素的最高价氧化物对应的水化物(浓度均为0.01mol.L-1)溶液的PH和原子序数的关系如下图所示。
(1)元素R在周期表中的位置是 。
(2)元素Y和W形成的Y2W2型化合物中含有化学键的类型为 。
(3)测定Z元素最高价氧化物对应水化物溶液物质的量浓度的方法为 。
II.短周期元素C、O、S能形成多种化合物,如CO2、CS2、COS等
(1)下列能说明碳、硫两种元素非金属性相对强弱的是 (填序号)
A.相同条件下水溶液的PH:Na2CO3 >Na2SO4
B.酸性:H2SO3 >H2CO3
C.CS2中碳元素为+4价,硫元素为-2价
(2)羰基硫(COS)可作为一种熏蒸剂,能防止某些昆虫、线虫的危害,其分子结构和CO2相似
①羰基硫(COS)的电子式为: 。
②羰基硫(COS)用氢氧化钠溶液处理及利用的过程如下:
已知A是一种正盐,则A的化学式为 ;若气体a为单质,反应 II的离子方程式为 。
ⅥA族的氧、硫、硒(Se)、碲(Te)等元素在化合物中常表现出多种化合价,含ⅥA族元素的化合物在研究和生产中有许多重要用途。请回答下列问题:
(1)氧元素能形成繁多的氧化物,请写出一个与CO2等电子的化合物_________________;
(2)把Na2O、SiO2、P2O5三种氧化物按熔沸点由高到低顺序排列_________________;
(3)原子的第一电离能是指气态电中性基态原子失去一个电子转化为气态基态正离子所需要的最低能量,O、S、Se原子的第一电离能由大到小的顺序为_________________;
(4)Se原子基态核外电子的排布式为_________________;
(5)SO32-离子中硫原子的杂化方式__________,该离子的立体构型为____________;
(6)某金属元素A的氧化物用作玻璃、瓷器的颜料、脱硫剂.其立方晶体的晶胞结构如图所示,则该氧化物的化学式为____________;