某强碱性溶液中可能含有的离子是K+、NH4+、Al3+、AlO2﹣、SO42﹣、SiO32﹣、CO32﹣、Cl﹣中的某几种离子,现进行如下实验:
①取少量的溶液用硝酸酸化后,加Ba(NO3)2溶液,无沉淀生成.
②另取少量溶液加入盐酸,其现象是:一段时间保持原样后,开始产生沉淀并逐渐增多,沉淀量基本不变后产生一种气体,最后沉淀逐渐减少至消失.
(1)肯定不存在的离子是 .
(2)写出步骤②中生成沉淀和气体的反应的离子方程式 .
(3)已知一定量的原溶液中加入5mL 0.2mol/L盐酸时,沉淀会完全消失,加入足量的硝酸银溶液可得到沉淀0.187g,则原溶液中是否含有Cl﹣? (填“有”或“无”).
在下图所示的转化关系中A、B、C、D、E、F、G、H、J均为常见物质。
已知B、D都是淡黄色固体,且A与D可的应生成离子化合物I,B与I的相对分子质量相同。请完成下列问题:
(1)写出下列物质的化学式:E,H;
(2)写出C的电子式:写出H2O2的电子式:;
(3)用电子式表示1的形成过程;
(4)写出B→C、E→F的化学反应方程式:B→C;E→F。
将下列物质进行分类:① H与
H与 H②O2与O3③乙醇与甲醚(CH3—O—CH3)④H2O与D2O⑤CH3CH2CH2CH3与CH3-CH(CH3)-CH3⑥C60与C35
H②O2与O3③乙醇与甲醚(CH3—O—CH3)④H2O与D2O⑤CH3CH2CH2CH3与CH3-CH(CH3)-CH3⑥C60与C35
(1)互为同位素的是(填编号、下同);
(2)互为同素异形体的是;
(3)互为同分异构体的是。
镍(Ni)是一种重要的金属,在材料科学等领域有广泛应用。
(1)Ni在元素周期表中的位置是。
(2)镍易形成配合物,如:Ni(CO)4、[Ni(NH3)6] 2+等。写出一种与配体CO互为等电子体的阴离子。配体NH3中N原子的杂化类型为, 它可用作致冷剂的原因是。若[Ni(NH3)6] 2+为正八面体构型,则[Ni(CO)2(NH3)4] 2+的结构有种。
(3)镍常见化合价为+2、+3, 在水溶液中通常只以+2 价离子的形式存在。+3价的镍离子具有很强的氧化性,在水中会与水或酸根离子迅速发生氧化还原反应。Ni3+的电子排布式为,NiO(OH)溶于浓盐酸的化学方程式为。
(4)镍和镧(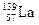 )组成的一种合金LaNix是较好的储氢材料,能快速可逆地存储和释放H2。LaNix的晶胞如图,其储氢原理为:镧镍合金吸附H2,H2解离为原子,H储存在其中形成LaNixH6。LaNixH6中,x=。该贮氢的镧镍合金、泡沫氧化镍、氢氧化钾溶液组成的镍氢电池被用于制作原子钟,反应原理为:
)组成的一种合金LaNix是较好的储氢材料,能快速可逆地存储和释放H2。LaNix的晶胞如图,其储氢原理为:镧镍合金吸附H2,H2解离为原子,H储存在其中形成LaNixH6。LaNixH6中,x=。该贮氢的镧镍合金、泡沫氧化镍、氢氧化钾溶液组成的镍氢电池被用于制作原子钟,反应原理为:
LaNixHy+y NiO(OH)  LaNix+y NiO+y H2O。写出其放电时负极的电极反应方程式
LaNix+y NiO+y H2O。写出其放电时负极的电极反应方程式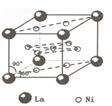
(12分)(1)前三周期元素中第一电离能最小的是(填元素符号),其基态原子的电子排布式为。第二周期非金属元素形成的氢化物中化学键极性最大的是(填分子式),该物质在CCl4中的溶解度比在水中的溶解度(填“大”或“小”)。
(2)物质形成分子间氢键和分子内氢键对物质性质的影响有显著差异。根据下表数据,形成分子间氢键的物质是(填物质字母代号)。
(3)晶格能的大小:MgONaCl,键能的大小:HBrHI。(填“>”、“=”或“<”)
(4)下列物质的熔点高低顺序,正确的是
A.金刚石>晶体硅>二氧化硅>碳化硅
B.CI4 > CBr4 > CCl4 > CH4
C.SiF4 > NaF > NaCl > NaBr
已知pH=2的高碘酸(H3IO5)溶液与pH=l2的NaOH溶液等体积混合,所得混合溶液呈酸性, 0.01mol/L的碘酸(HIO3)或高锰酸(HMnO4)溶液与pH=l2的NaOH溶液等体积混合,所得混合溶液均呈中性, 请回答下列问题:
(1)高碘酸是(填写“强酸”或“弱酸”),原因是。
(2)已知高碘酸和硫酸锰在溶液中反应生成高锰酸和碘酸及硫酸, 此反应的氧化剂是________,反应的离子方程式为。