实验室用密度为1.18g/mL,质量分数为36.5%浓盐酸配制250mL0.1mol/L的盐酸溶液,填空并请回答下列问题:
(1)配制250mL0.1mol/L的盐酸溶液
| 应量取盐酸体积/mL |
应选用容量瓶的规格/mL |
除容量瓶外还需的其它仪器 |
| |
|
|
(2)配制时,其正确的操作顺序是(字母表示,每个字母只能用一次) ;
A.用30mL水洗涤烧杯2—3次,洗涤液均注入容量瓶,振荡
B.用量筒准确量取所需的浓盐酸的体积,沿玻璃棒倒入烧杯中,再加入少量水(约30mL),用玻璃棒慢慢搅动,使其混合均匀
C.将已冷却的盐酸沿玻璃棒注入250mL的容量瓶中
D.将容量瓶盖紧,振荡,摇匀
E.改用胶头滴管加水,使溶液凹面恰好与刻度相切
F.继续往容量瓶内小心加水,直到液面接近刻度1—2cm处
(3)操作A中,将洗涤液都移入容量瓶,其目的是 ,溶液注入容量瓶前需恢复到室温,这是因为 ;
(4)若出现如下情况,对所配溶液浓度将有何影响(填“偏高”、“偏低”或“无影响” )
若没有进行A操作 ;若加蒸馏水时不慎超过了刻度 ;若定容时俯视刻度线 。
(5)若实验过程中出现如下情况如何处理:加蒸馏水时不慎超过了刻度 ;向容量瓶中转移溶液时(实验步骤(2))不慎有液滴掉在容量瓶外 。
氨在人类的生产和生活中有着广泛的应用.某化学兴趣小组利用图一装置探究氨气的有关性质。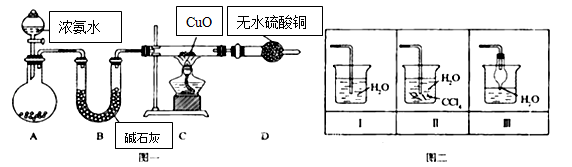
(1)装置A中烧瓶内试剂可选用 (填序号).B的作用是 .
a.碱石灰b.生石灰 c.浓硫酸d.烧碱溶液
(2)连接好装置并检验装置的气密性后,装入药品,然后应先 (填I或Ⅱ).
Ⅰ.打开旋塞逐滴向圆底烧瓶中加入氨水Ⅱ.加热装置C
(3)实验中观察到C中CuO粉末变红,D中无水硫酸铜变蓝,并收集到一种单质气体,则该反应相关化学方程式为 .该反应证明氨气具有 性.
(4)该实验缺少尾气吸收装置,图二中能用来吸收尾气的装置是 (填装置序号).
(5)氨气极易溶于水,若标准状况下,将2.24L的氨气溶于水配成1L溶液,所得溶液的物质的量浓度为_______mol/L.
实验室配制物质的量浓度均为0.2mol/L 的NaCl溶液和稀H2SO4各480mL.提供的试剂是:NaCl固体和98%的浓H2SO4(密度为1.84g/cm3)及蒸馏水。
(1)应用托盘天平称量NaCl g,应用10mL量筒量取H2SO4 mL;
(2)配制两种溶液时都需要的仪器是 ;
(3)稀释浓H2SO4时应注意 ;
(4)在配制上述溶液实验中,下列操作引起结果偏低的有 (填序号)
| A.在烧杯中溶解溶质搅拌时,溅出少量溶液 |
| B.没有用蒸馏水洗烧杯2~3次,并将洗液移入容量瓶中 |
| C.定容时,加水超过了刻度线,倒出一些再重新加水到刻度线 |
| D.将所配溶液从容量瓶转移到试剂瓶时,有少量溅出 |
E、把配好的溶液倒入刚用蒸馏水洗净的试剂瓶中备用
F、容量瓶刚用蒸馏水洗净,没有烘干
G、量筒量取浓H2SO4后没有用蒸馏水洗涤2~3次,并将洗液移入容量瓶中.
某同学需要用到120 mL 1 mol/L的盐酸溶液,现用密度为1.18 g/mL,质量分数为36.5%浓盐酸配制,填空并请回答下列问题:
(1)配制1 mol/L的盐酸溶液
| 量筒量取浓盐酸体积/mL |
应选用量筒的规格(可供选择的规格10 mL、25 mL、50 mL) |
应选用容量瓶的规格(可供选择的规格100 mL、250 mL、500 mL) |
除容量瓶外还需要的其它仪器 |
| ① |
② |
③ |
④ |
(2)配制时,其正确的操作顺序是(字母表示,每个字母只能用一次) __ _____;
A、用30 mL水洗涤烧杯内壁和玻璃棒2—3次,洗涤液均注入容量瓶,振荡
B、用量筒准确量取所需的浓盐酸的体积,将量好的浓盐酸倒入烧杯中,再加入少量水(约30 mL),用玻璃棒慢慢搅动,使其混合均匀
C、将已冷却的盐酸沿玻璃棒注入容量瓶中
D、将容量瓶盖紧,振荡,摇匀
E、继续往容量瓶内小心加水,直到溶液凹面恰好与刻度相切
(3)指出本实验的操作错误的地方,并进行更正 。
(4)若出现如下情况,对所配溶液浓度将有何影响(填“偏高”、“偏低”或“无影响”):
①所用的浓盐酸长时间放置在密封不好的容器中 ;
②若加蒸馏水时不慎超过了刻度 ;
③若定容时俯视刻度线___________________;
④用量筒量取浓盐酸时仰视 ;
(8分)某同学利用如图所示的装置进行有关实验。其中气体A的主要成分是氯气,还含有少量空气和水蒸气。请回答下列问题: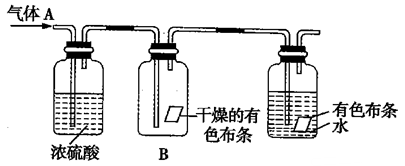
(1)该实验的主要目的是研究干燥的氯气是否具有 作用。
(2)浓硫酸的作用是
(3)实验过程中观察到B瓶中干燥的有色布条 (填“A.退”或“B.不退”)色。
(4)在该实验中,装置存在缺陷,还应加盛有 的装置。
(14分)如图是有关钠与水反应及产物检验的实验装置。实验开始时先向管内加入滴有酚酞的水,使水位达到B端管口,然后迅速塞紧橡胶塞并拔掉大头针,此时Na掉入水中。回答下列问题: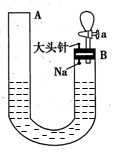
(1)钠与水反应的化学方程式为 。
(2)钠与水反应的现象有很多,不同的现象证明不同的性质。
①能证明钠的密度比水小的现象是 。
②能证明钠的熔点低的现象是 。
③能证明有氢氧化钠生成的现象是 。
④能证明有气体产生的现象是A端液面 (填“A.上升”、“B.下降”或“C.不变”,下同),B端液面 。
⑤钠燃烧产物与H2O反应的化学方程式 。