实验室用氯化钠固体配制1.00mol/L的NaCl溶液0.5L,回答下列问题
(1)根据计算,需称取氯化钠 g。
(2)配制时,必须用到的玻璃仪器有 。
(3)配制溶液有下列几步操作:a.溶解,b.摇匀,c.洗涤,d.冷却,e.称量,f.将溶液移至容量瓶,g.贴标签,h.定容。正确的操作顺序是 。
(4)下列操作结果使溶液物质的量浓度偏低的是 。
| A.没有将洗涤液转入容量瓶中 | B.容量瓶洗涤后,未经干燥处理 |
| C.定容时,俯视容量瓶的刻度线 | D.加水定容时,水的量超过了刻度线 |
下图为实验室制取和收集纯净干燥的氯气,并进行氯气的性质实验的装置图: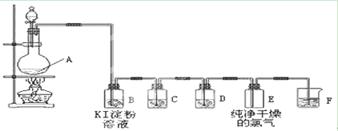
(1)反应前,在装置A中装浓盐酸(填写仪器名称)
装MnO2(填写仪器名称)
装置A中反应的化学方程式为 。
(2)装置B中的现象是
反应的化学方程式为 。
(3)装置D中所装试剂是,作用是。
(4)装置F中发生反应的离子方程式为
实验室用NaOH固体配制250mL 1.25mol/L的NaOH溶液,填空并请回答下列问题:
(1)配制250mL 1.25mol/L的NaOH溶液
| 应称取NaOH的质量/g |
应选用容量瓶的规格/mL |
除天平(砝码)、量筒、容量瓶、玻璃棒、胶头滴管外还需要的其它仪器 |
(2)容量瓶上需标有以下五项中的;A
①温度 ②浓度 ③容量 ④压强 ⑤刻度线
(3)配制时,其正确的操作顺序是(字母表示,每个字母只能用一次);
A、用30mL水洗涤烧杯2—3次,洗涤液均注入容量瓶,振荡
B、用天平准确称取所需质量的NaOH,放入烧杯,加入少量水(约30mL),用玻璃棒慢慢搅拌,使其充分溶解
C、将已冷却的NaOH溶液沿玻璃棒注入250mL的容量瓶中
D、将容量瓶盖紧,颠倒摇匀
E、改用胶头滴管加水,使溶液凹面恰好与刻度相切
F、继续往容量瓶内小心加水,直到液面接近刻度1—2cm处
(4)下列配制的溶液浓度偏低的是;
A、称量NaOH时,砝码错放在左盘
B、向容量瓶中转移溶液时,不慎有液滴洒在容量瓶外面
C、加蒸馏水时不慎超过了刻度线
D、定容时俯视刻度线
E、配制前,容量瓶中有少量蒸馏水
西安北郊古墓中曾出土一青铜锤(一种酒具),表面附着有绿色固体物质,打开盖子酒香扑鼻,内盛有26 kg青绿色液体,专家认定是2000多年前的“西汉美酒”。这是我国考古界、酿酒界的一个重大发现。(1)上述报道引发了某校化学兴趣小组同学的关注,他们收集家中铜器表面的绿色固体进行探究.
提出问题:铜器表面附着绿色固体物质是由哪些元素组成的?
猜想:查阅相关资料后,猜想绿色固体物质可能是铜绿.
实验步骤:
①对试管内的绿色固体进行加热,至完全分解.观察到A装置中绿色固体逐渐变成黑色,B装置中无水硫酸铜变成蓝色,C装置中澄清石灰水变浑浊.
②取少量加热后生成的黑色固体于试管中,加入稀硫酸.观察到黑色固体逐渐溶解,溶液变成蓝色.
③取少量上述蓝色溶液于试管中,浸入一根洁净的铁丝.观察到铁丝表面有红色物质析出.
④实验结论:绿色固体物质中含有________、________、________、________等元素.(提示:装置内的空气因素忽略不计)
(2)表达与交流:①图中标有a、b的仪器名称是:a:________;b:________.
②上述实验步骤③中发生反应的离子方程式为____________________________。
③反应完成后,如果先移去酒精灯,可能出现的现象是______________________。
④如果将B、C两装置对调行吗?____。为什么?________。
盐酸、硫酸和硝酸都是重要的化工原料,也是化学实验室里必备的重要试剂。请回答下列问题:
(1)常温下,可用铁、铝制的容器盛放浓硫酸,说明浓硫酸具有 性。用玻璃棒蘸取浓硫酸滴在纸上,纸逐渐变黑,说明浓硫酸具有 性。
(2)硝酸铜是制备Cu-Zn-Al系催化剂的重要原料,工业上用洗净的废铜屑作原料来制备硝酸铜。下列制备方法符合“绿色化学”思想的是 (填序号)。
① Cu + HNO3(浓)→ Cu(NO3)2 ② Cu + HNO3(稀)→ Cu(NO3)2
③ Cu CuO
CuO Cu(NO3)2
Cu(NO3)2
(3)①在100mL 18mol·L-1的浓硫酸中加入过量的铜片,加热使之充分反应,测得产生的气体在标准状况下的体积可能是 。
| A.40.32L | B.30.24L | C.20.16L | D.13.44L |
②若使上述反应①中剩余的铜片继续溶解,可向其中加入硝酸钠,写出反应的离子方程式_______________________________________________________________________。
(4)若将12.8g铜跟一定质量的浓HNO3反应,铜消耗完时,共产生气体5.6L(标准状况),则所耗HNO3的物质的量 mol。
(5)某同学向浸泡铜片的稀盐酸中加入H2O2后,铜片溶解,并且该反应的产物只有氯化铜和水。该反应的化学方程式为 。
绿矾( )是治疗缺铁性贫血药品的重要成分。下面是以市售铁屑(含少量锡、氧化铁等杂质)为原料生产纯净绿矾的一种方法:
)是治疗缺铁性贫血药品的重要成分。下面是以市售铁屑(含少量锡、氧化铁等杂质)为原料生产纯净绿矾的一种方法: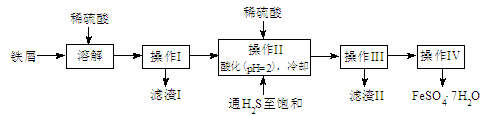
已知:室温下饱和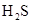 溶液的
溶液的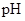 约为3.9,SnS沉淀完全时溶液的
约为3.9,SnS沉淀完全时溶液的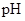 为1.6;
为1.6; 开始沉淀时溶液的
开始沉淀时溶液的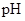 为3.0,沉淀完全时的
为3.0,沉淀完全时的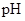 为5.5。
为5.5。
(1)检验制得的绿矾晶体中是否含有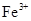 的实验操作是
的实验操作是
(2)操作II中,通入硫化氢至饱和的目的是 ;在溶液中用硫酸酸化至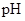 =2的目的是 。
=2的目的是 。
(3)操作IV的顺序依次为: 、冷却结晶、 。
(4)操作IV得到的绿矾晶体用少量冰水洗涤,其目的是:①除去晶体表面附着的硫酸等杂质;② 。
(5)测定绿矾产品中 含量的方法是:a.称取2.8500g绿矾产品,溶解,在250mL容量瓶中定容;b.量取25.00mL待测溶液于锥形瓶中;c.用硫酸酸化的0.01000mol/LKMnO4溶液滴定至终点,消耗KMnO4溶液体积的平均值为20.00mL。
含量的方法是:a.称取2.8500g绿矾产品,溶解,在250mL容量瓶中定容;b.量取25.00mL待测溶液于锥形瓶中;c.用硫酸酸化的0.01000mol/LKMnO4溶液滴定至终点,消耗KMnO4溶液体积的平均值为20.00mL。
①滴定时发生反应的离子方程式为: 。
②计算上述样品中 的质量分数为 (用小数表示,保留三位小数)。
的质量分数为 (用小数表示,保留三位小数)。