绿矾( )是治疗缺铁性贫血药品的重要成分。下面是以市售铁屑(含少量锡、氧化铁等杂质)为原料生产纯净绿矾的一种方法:
)是治疗缺铁性贫血药品的重要成分。下面是以市售铁屑(含少量锡、氧化铁等杂质)为原料生产纯净绿矾的一种方法:
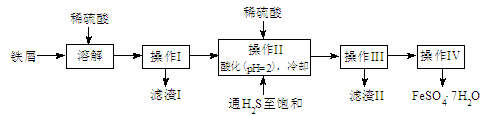
已知:室温下饱和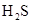 溶液的
溶液的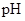 约为3.9,SnS沉淀完全时溶液的
约为3.9,SnS沉淀完全时溶液的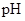 为1.6;
为1.6; 开始沉淀时溶液的
开始沉淀时溶液的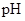 为3.0,沉淀完全时的
为3.0,沉淀完全时的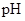 为5.5。
为5.5。
(1)检验制得的绿矾晶体中是否含有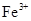 的实验操作是
的实验操作是
(2)操作II中,通入硫化氢至饱和的目的是 ;在溶液中用硫酸酸化至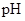 =2的目的是 。
=2的目的是 。
(3)操作IV的顺序依次为: 、冷却结晶、 。
(4)操作IV得到的绿矾晶体用少量冰水洗涤,其目的是:①除去晶体表面附着的硫酸等杂质;② 。
(5)测定绿矾产品中 含量的方法是:a.称取2.8500g绿矾产品,溶解,在250mL容量瓶中定容;b.量取25.00mL待测溶液于锥形瓶中;c.用硫酸酸化的0.01000mol/LKMnO4溶液滴定至终点,消耗KMnO4溶液体积的平均值为20.00mL。
含量的方法是:a.称取2.8500g绿矾产品,溶解,在250mL容量瓶中定容;b.量取25.00mL待测溶液于锥形瓶中;c.用硫酸酸化的0.01000mol/LKMnO4溶液滴定至终点,消耗KMnO4溶液体积的平均值为20.00mL。
①滴定时发生反应的离子方程式为: 。
②计算上述样品中 的质量分数为 (用小数表示,保留三位小数)。
的质量分数为 (用小数表示,保留三位小数)。
“化学多米诺实验”是利用化学反应中气体产生的压力,使多个化学反应依次发生。下图所示就是一个“化学多米诺实验”,其中A~F装置中分别盛放的物质为:
| A.稀硫酸; | B.锌粒; |
| C.某溶液; | D.CaCO3固体;E、滴有紫色石蕊试液的蒸馏水;F、足量的澄清石灰水 |

请回答下列问题:
⑴反应开始后,若E中出现红色,F中有白色沉淀生成,则C中的物质可能是。
⑵装置D中的离子方程式,该反应的类型是,
装置F中的离子方程式。
⑶上图B~F装置中发生氧化还原反应的是(填编号)。
用单线桥表示出电子转移。
FeSO4?7H2O广泛用于医药和工业领域。
以下是FeSO4?7H2O的实验室制备流程图。
根据题意完成下列填空:
(1)碳酸钠溶液能除去酯类油污,是因为(用离子方程式表示),反应Ⅰ需要加热数分钟,其原因是。
(2)废铁屑中含氧化铁,无需在制备前除去,理由是
(用离子方程式回答),。
(3)判断反应Ⅱ完成的现象是:。
以下是测定某补血剂(FeSO4?7H2O)中铁元素含量的流程图。根据题意完成下列填空: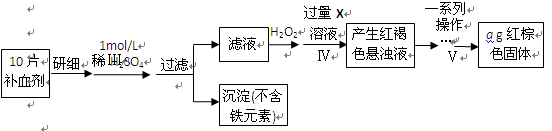
(4)步骤Ⅲ需要100mL1mol/L的稀硫酸,用98.3%,ρ=1.84g/cm3的浓硫酸配制,所用的仪器有量筒、烧杯、玻璃棒、胶头滴管及。写出步骤Ⅳ的离子方程式:。
(5)步骤Ⅴ一系列操作依次是:①过滤②洗涤③④冷却⑤称量⑥恒重操作。操作⑥的目的是。
(6)假设实验无损耗,则每片补血剂含铁元素的质量g(用含a的代数式表示)。
I.仅用下列装置,检验木炭和浓硫酸反应产生的混和气体中含有SO2和CO2。在下列表格中填写对应的药品和实验现象。
| 实验装置 |
检验气体 |
试剂名称 |
实验现象 |
| A |
SO2 |
||
| B |
CO2 |
II.利用下列装置来电解饱和食盐水,并测量电解产生的氢气的体积(约6mL)和检验氯气的氧化性(不应将多余的氯气排入空气中)。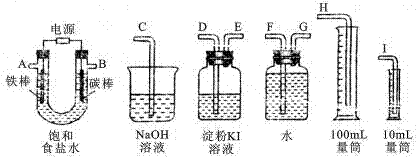
(1)将上面各仪器连成一整套装置,各种仪器接口的连接顺序(填编号)是:A接______________,B接______________。
(2)请写出铁棒电极上发生的电极反应式__________________________。
(3)能说明氯气具有氧化性的实验现象是_______________________________。
(4)若U管中装入的饱和食盐水为50mL(电解前后溶液体积变化可忽略),当收集到的氢气为5.6mL(标准状况)时停止通电,摇匀U型管内的溶液,取20.00mL该溶液于锥形瓶内,用0.01mol/L的盐酸滴定时,滴定管起始读数为1.00mL,滴定终点时,滴定管的读数为_______ mL。
甲、乙两同学为探究SO2与可溶性钡的强酸盐能否反应生成白色BaSO3沉淀,用下图所示装置进行实验(夹持装置和A中加热装置已略,气密性已检验)。
实验操作和现象:
| 操作 |
现象 |
| 关闭弹簧夹,滴加一定量浓硫酸,加热 |
A中有白雾生成,铜片表面产生气泡 B中有气泡冒出,产生大量白色沉淀 C中产生白色沉淀,液面上方略显浅棕色并逐渐消失 |
| 打开弹簧夹,通入N2,停止加热,一段时间后关闭 |
|
| 从B、C中分别取少量白色沉淀,加稀盐酸 |
均未发现白色沉淀溶解 |
(1)A中反应的化学方程式是。
(2)C中白色沉淀是,该沉淀的生成表明SO2具有性。
(3)C中液面上方生成浅棕色气体的化学方程式是。
(4)分析B中不溶于稀盐酸的沉淀产生的原因,甲认为是空气参与反应,乙认为是白雾参与反应。
①为证实各自的观点,在原实验基础上:
甲在原有操作之前增加一步操作,该操作是;
乙在A、B间增加洗气瓶D,D中盛放的试剂是。
②进行实验,B中现象:
| 甲 |
大量白色沉淀 |
| 乙 |
少量白色沉淀 |
检验白色沉淀,发现均不溶于稀盐酸。结合离子方程式解释实验现象异同的原因:。
(5)合并(4)中两同学的方案进行实验。B中无沉淀生成,而C中产生白色沉淀,由此得出的结论是。
某小组查阅资料得知:C2O42-+MnO4-+H+→ CO2↑+Mn2++H2O(未配平),欲利用该反应测定某草酸钠(Na2C2O4)样品中草酸钠的质量分数。该小组称量1.34 g草酸钠样品溶于稀硫酸中,然后用0.200 mol·L-1的酸性高锰酸钾溶液进行滴定(其中的杂质不跟高锰酸钾和稀硫酸反应)。
(1)滴定前是否要滴加指示剂?(填“是”或“否”),请说明理由。
(2)滴定时用(填a或b)滴定管盛装KMnO4标准溶液。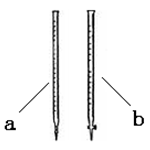
(3)达到终点时消耗了15.00 mL的高锰酸钾溶液,样品中草酸钠的质量分数为。