某无色稀溶液X中,可能含有下表所列离子中的某几种。
| 阴离子 |
CO32-、SiO32-、AlO2-、Cl- |
| 阳离子 |
Al3+、Fe3+、Mg2+、NH4+、Na+ |
现取该溶液适量,向其中加入某试剂Y,产生沉淀物质的量(n)与加入试剂的体积(V)关系如图所示。

(1)若Y是盐酸,所得到的关系图如甲所示,则oa段转化为沉淀的离子(指来源于X溶液的,下同)是 ,ab段发生反应的离子 ,bc段发生反应的离子方程式 。
(2)若Y是NaOH溶液,所得到的关系图如乙所示,则X中一定含有的离子是 ,假设X溶液只含这几种离子,则溶液各离子物质的量之比为 ,ab段反应的离子方程式为 。
用含有Al2O3、SiO2和少量FeO·xFe2O3的铝灰制备Al2(SO4)3·18H2O,工艺流程如下(部分操作和条件略):
Ⅰ.向铝灰中加入过量稀H2SO4,过滤;
Ⅱ.向滤液中加入过量KMnO4溶液,调节溶液的pH约为3;
Ⅲ.加热,产生大量棕色沉淀,静置,上层溶液呈紫红色;
Ⅳ,加入MnSO4至紫红色消失,过滤;
V.浓缩、结晶、分离,得到产品。
(1)H2SO4溶解Al2O3的离子方程式是_______________________。
(2)将MnO4—氧化Fe2+的离子方程式补充完整:
1MnO4—+Fe2++________===1Mn2++Fe3++________
(3)已知:
生成氢氧化物沉淀的pH
| Al(OH)3 |
Fe(OH)2 |
Fe(OH)3 |
|
| 开始沉淀时 |
3.4 |
6.3 |
1.5 |
| 完全沉淀时 |
4.7 |
8.3 |
2.8 |
注:金属离子的起始浓度为0.1 mol·L-1
根据表中数据解释步骤Ⅱ的目的:________________________。
(4)已知:一定条件下,MnO4—可与Mn2+反应生成MnO2。
①向Ⅲ的沉淀中加入浓HCl并加热,能说明沉淀中存在MnO2的现象是____________________________。
④Ⅳ中加入MnSO4的目的是__________________________。
36 g H2O与80 g D2O的物质的量之比是______,分子中所含质子数之比是__________,所含中子数之比是________,它们分别与Na反应时,所放出气体体积之比(同条件)是______,质量之比是________。
有H、D、T三种原子,各自可形成双原子分子H2、D2、T2,请填写下列各题。
(1)标准状况下,它们的密度之比为________。
(2)相同物质的量的三种单质中,质子数之比为________。
(3)各1 g三种单质中,它们的质子数之比为________。
(4)同温同压下,1 L各单质气体中所含电子数之比为________。
用
| A.质子数、 | B.中子数、 | C.最外层电子数、 | D.电子层数填写下列空格。 |
(1)原子种类由________决定。(填写字母序号,下同)
(2)元素种类由________决定。
(3)元素有无同位素由________决定。
(4)1~18号元素的化合价主要由________决定。
(5)元素的化学性质由________决定。
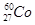 的衰变方程式为
的衰变方程式为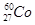 =
=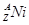 +
+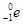 +Ve,其中Ve是反中微子,它的电荷为零,静止质量可以为零。
+Ve,其中Ve是反中微子,它的电荷为零,静止质量可以为零。
(1)下列关于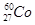 的叙述中,错误的是________(填序号)。
的叙述中,错误的是________(填序号)。
A.质子数是27B.电子数是27
C.质量数是27D.中子数是60
(2)在上述衰变方程中,衰变产物Ni的质量数A为______,核电荷数Z为________。
(3)元素的化学性质主要取决于________(填序号)。
A.最外层电子数B.核内中子数
C.核内质子数D.质量数不同
(4)不同种元素的本质区别是________(填序号)。
A.质子数不同B.中子数不同
C.电子数不同 D.质量数不同