少量铁粉与100 mL 0.01 mol/L的稀盐酸反应,反应速率太慢。为了加快此反应速率而不改变H2的产量,可以使用如下方法中的
①加H2O ②加NaOH固体③滴入几滴浓盐酸 ④加CH3COONa固体 ⑤加NaCl溶液 ⑥滴入几滴硫酸铜溶液 ⑦升高温度(不考虑盐酸挥发) ⑧改用10 mL 0.1 mol/L盐酸
| A.①⑥⑦ | B.③⑤⑧ | C.③⑦⑧ | D.⑤⑦⑧ |
肉毒碱是具有多种生理功能的氨基酸类物质,又名维生素Bt,是一种类维生素。1927年测定了它的结构,1958年发现其能促进脂肪代谢,1985年被指定为“多功能营养品”。下列有关肉毒碱的说法不正确的是()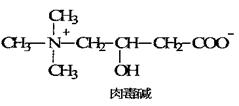
| A.肉毒碱的分子式为:C7H15NO3 |
| B.肉毒碱能与氢氧化钠反应但不能与盐酸反应 |
| C.一定条件下肉毒碱能发生酯化反应、消去反应、取代反应 |
| D.H核磁共振谱(1H-NMR)证明分子中的3个甲基上的氢属等效氢 |
HgCl2的稀溶液可用作消毒剂。已知HgCl2的熔点是277℃,熔融状态的HgCl2不能导电,HgCl2的稀溶液有弱的导电能力,则下列说法正确的是()
| A.HgCl2不属于分子晶体 | B.HgCl2属于离子晶体 |
| C.HgCl2不属于电解质 | D.HgCl2属于弱电解质 |
设NA表示阿伏加德罗常数,下列叙述正确的
是()
| A.71 g氯气被还原得到的电子数为2NA |
| B.100 mL l mol·L-1的碳酸钠溶液中含有的CO32-数为0.1NA |
| C.标准状况下,2.24 L苯中含有的碳原子数为0.6 NA |
| D.用含有少量锌、铁、银等杂质的粗铜作阳极电解精炼,当阴极析出64 g金属时阳极失去的电子数小于2NA |
右图曲线a和b是盐酸与氢氧化钠溶液相互滴定的滴定曲线,下列叙述正确的是()
| A.盐酸的物质的量浓度为1 mol·L |
| B.P点时反应恰好完全,溶液早中性 |
| C.曲线a是盐酸滴定氢氧化钠的滴定曲线 |
| D.酚酞不能用丁本实验的指示剂 |
共价键、离子键和分子间作用力是粒子之间的三种不同作用力。下列物质的品体中:①Na2O2②CO2③金刚石④NaCl⑤白磷,含有上述两种作用力的是()
| A.①②⑤ | B.①②③ |
| C.②④⑤ | D.②③⑤ |