镍镉(Ni-Cd)可充电电池在现代生活中有广泛应用。已知某镍镉电池的电解质溶液为KOH溶液,其充、放电按下式进行:Cd + 2NiOOH + 2H2O Cd(OH)2 +2Ni(OH)2
Cd(OH)2 +2Ni(OH)2
有关该电池的说法正确的是
| A.充电时阳极反应:Ni(OH)2-e— + OH- ="=" NiOOH + H2O |
| B.充电过程是化学能转化为电能的过程 |
| C.放电时负极附近溶液的碱性不变 |
| D.放电时电解质溶液中的OH- 向正极移动 |
设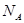 表示阿伏加德罗常数,下列叙述中正确的是
表示阿伏加德罗常数,下列叙述中正确的是
①.31g白磷含有的P—P键数为NA
②. 1mol CH3+(碳正离子)中含有电子数为10NA
③. 1mol铜与足量硫蒸气反应,转移电子数为2NA
④.1mol Mg与足量O2或N2反应生成MgO或Mg3N2,均失去2NA个电子
⑤.用惰性电极电解CuCl2溶液,阴极析出16g铜时,线路中通过的电子数为NA
⑥.0.84 g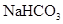 晶体中阳离子和阴离子总数为0.03NA
晶体中阳离子和阴离子总数为0.03NA
⑦.3.9gNa2O2吸收足量的CO2时转移的电子数是0.05NA
⑧.标准状况下,3.2g铜与足量的浓硝酸反应生成的气体含有的分子数是0.1NA
⑨.28 g C16O与28 g C18O中含有的质子数均为14×6.02×1023
⑩.标准状况下,22.4 L氯气与足量氢氧化钠溶液反应转移的电子数为2×6.02×1023
A ②④⑦⑧ B ③④⑥⑦⑧ C ④⑦ D④⑥⑨⑩
下列各溶液中,各粒子的物质的量浓度关系正确的是
| A.0.1mol/LNa2CO3溶液中:c(Na+) + c(H+) = c(CO32-) + c(HCO3-) + c(OH-) |
| B.0.1mol/L(NH4)2SO4溶液中:c(SO42-) > c(NH4+) > c(H+) > c(OH-) |
| C.0.1mol/LNaHCO3溶液中:c(OH-) = 2c(H2CO3) + c(HCO3-) + c(H+) |
| D.0.1mol/LNa2S溶液中:c(Na+) = 2c(S2-) +2c(HS-) + 2c(H2S) |
三氟化氮(NF3)是微电子工业中优良的等离子刻蚀气体,它在潮湿的环境中能发生反应:
3 NF3 + 5 H2O =" 2" NO + HNO3 + 9 HF。下列有关该反应的说法正确的是
| A.NF3是氧化剂,H2O是还原剂 |
| B.还原剂与氧化剂的物质的量之比为2:1 |
| C.若生成0.2 mol HNO3,则转移0.2 mol电子 |
| D.NF3在潮湿的空气中泄漏会产生红棕色气体 |
已知常温下可用Co2O3制备Cl2,反应前后存在六种微粒:Co2O3﹑H2O﹑Cl2、H+ 、Cl-和Co2+。下列叙述不正确的是
| A.氧化产物为Cl2 |
| B.氧化剂与还原剂的物质的量之比为1∶2 |
| C.若有3mol H2O生成,则反应中有2mol电子转移 |
| D.当该反应生成2.24L Cl2时,则反应中有0.1mol电子转移 |
设某元素某原子核内的质子数为m,中子数为n,则下述论断正确的是
| A.不能由此确定该元素的原子量 |
| B.这种元素的原子量为m+n |
| C.若碳原子质量为W克,此原子的质量为(m+n)W克 |
| D.核内中子和质子共同决定元素种类 |