工业上制备氯化铜时,是将浓盐酸用蒸汽加热至80 ℃左右,慢慢加入粗制氧化铜粉末(含杂质氧化亚铁),充分搅拌,使之溶解,反应如下: CuO+2HCl=CuCl2+H2O;FeO+2HCl=FeCl2+H2O。已知: 当pH≥9.6时,Fe2+以Fe(OH)2形式完全沉淀; pH≥6.4时, Cu2+以Cu(OH)2形式完全沉淀;pH在3~4时, Fe3+以Fe(OH)3形式完全沉淀。除去溶液中的Fe2+可以采用的方法是
| A.直接加碱,调整溶液pH≥9.6 |
| B.加纯铜粉,将Fe2+还原出来 |
| C.先将Fe2+氧化Fe3+成再调整pH至3~4 |
| D.通入硫化氢,使Fe2+直接沉淀 |
某无色气体可能含有CO2、CO、H2、H2O(g)中的一种或几种,依次进行以下处理(每步反应均进行完全)。①通过赤热的炭层后,恢复到原状态,气体体积不变;②通过灼热的CuO时,固体变红色;③通过白色CuSO4粉末时,粉末变蓝色;④通入澄清石灰水中,石灰水变浑浊。下列判断中,正确的是
| A.原混合气体中一定没有CO、H2O,一定含有H2和CO2 |
| B.①②③④中都发生了氧化还原反应 |
| C.③中的反应为:CO2+3H2O+2CuSO4 ="===" Cu2(OH)2CO3+2H2SO4 |
| D.由①④说明,实验过程中一定有CO2生成 |
用右图所示装置进行如下实验,能达到实验目的的是
| A.瓶中盛满水,从B口进气,用排水法收集NO2 |
| B.瓶中盛适量浓硫酸,从A口进气来干燥NH3 |
| C.从B口进气,用排空气法收集CO2 |
| D.瓶中装满水,A口连导管并伸入量筒中,从B口进气,用排水法测量生成H2的体积 |
分析推理是化学学习方法之一。下列实验推理中,正确的是
| A.灼热的铂丝与NH3、O2混合气接触,铂丝保持红热,说明氨的氧化反应是放热反应 |
| B.某雨水的pH小于5.6,说明雨水中一定溶解了SO2 |
C.某溶液中加入氯化钡溶液,生成白色沉淀,说明原溶液中一定含有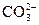 |
| D.将镁条和铝片用导线连接再插进稀NaOH溶液,镁条上产生气泡,说明镁比铝活泼 |
下表中a、b、c表示相应仪器中加入的试剂,可用右图装置制取、净化、收集的气体是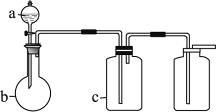
| 编号 |
气体 |
a |
b |
c |
| A |
NH3 |
浓氨水 |
生石灰 |
碱石灰 |
| B |
CO2 |
盐酸 |
碳酸钙 |
饱和NaHCO3 |
| C |
NO |
稀HNO3 |
铜屑 |
H2O |
| D |
NO2 |
浓HNO3 |
铜屑 |
NaOH溶液 |
已知:为使Fe3+、Fe2+、Zn2+较完全的形成氢氧化物沉淀,溶液的pH应分别为3.7、9.6、4.4左右。某硫酸锌酸性溶液中含有少量Fe3+、Fe2+,为除去这些离子制得纯净的硫酸锌,应加入的试剂是
| A.NaOH溶液 |
| B.氨水 |
| C.KMnO4、ZnCO3 |
| D.H2O2、ZnO |