将0.4gNaOH和1.06g Na 2CO3混合并配成溶液,向溶液中滴加0.1mol·L-1稀盐酸。下列图像能正确表示加入盐酸的体积和生成CO2的物质的量的关系的是
(NA为阿伏加德罗常数的值) 下列说法正确的是()
A.25℃时,pH=13的1.0L Ba(OH) 2溶液中含有的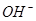 数目为0.2NA 数目为0.2NA |
| B.标准状况下,11.2L的戊烷所含的分子数为0.5NA |
| C.标准状况下,2.24 L Cl2溶于水中达到饱和,转移的电子数是0.1NA |
| D.现有乙烯、丙烯、丁烯的混合气体共14g,其原子数为3NA |
.利用实验器材(规格和数量不限),能完成相应实验的一项是()
| 实验器材(省略夹持装置) |
相应实验 |
|
| A |
烧杯、玻璃棒、蒸发皿 |
硫酸铜溶液的浓缩结晶 |
| B |
烧杯、玻璃棒、胶头滴管、滤纸 |
用盐酸除去硫酸钡中的少量碳酸钡 |
| C |
烧杯、玻璃棒、胶头滴管、容量瓶 |
用固体氯化钠配制0.5mol/L的溶液 |
| D |
烧杯、玻璃棒、胶头滴管、分液漏斗 |
用溴水和CCl4除去NaBr溶液中的少量NaI |
将Mg、Cu组成的混合物26.4g投入到适量的稀硝酸中,固体完全溶解,收集到标准状况下的NO气体8.96L,向反应后的溶液中加入过量的5mol·L-1的NaOH溶液300mL,金属离子完全沉淀。则形成沉淀的质量是( )
| A.43.2g | B.46.8g | C.53.6g | D.63.8g |
在甲、乙、丙、丁四个烧杯内分别放入0.1mol的钠、氧化钠、过氧化钠和氢氧化钠,然后各加入100mL水,搅拌,使固体完全溶解,则甲、乙、丙、丁所得溶液里溶质的质量分数大小顺序是
| A.甲<乙<丙<丁 | B.丁<甲<乙=丙 |
| C.甲=丁<乙=丙 | D.丁<甲<乙<丙 |
某二价金属的碳酸盐和酸式碳酸盐的混合物,跟足量的稀盐酸反应,消耗H+和生成CO2物质的量之比为6:5,则该混合物中碳酸盐和酸式碳酸盐的物质的量之比是()
| A.1:1 | B.1:2 | C.1: 3 | D.1:4 |