向59.2gFe2O3和FeO的混合物中加入某浓度的稀硝酸1.0L,固体物质完全反应,生成NO和Fe(NO3)3.在所得溶液中加入1.0mol/L的NaOH溶液2.8L,此时溶液呈中性,金属离子已完全沉淀,沉淀质量为85.6g.下列有关说法错误的是
| A.Fe2O3与FeO的物质的量之比为1:6 |
| B.硝酸的物质的量浓度为3.0 mol/L |
| C.产生的NO在标准状况下的体积为4.48 L |
| D.Fe2O3,FeO与硝酸反应后剩余HNO3为0.2 mol |
下列电子式书写正确的是
| A.∶N∶∶∶N∶ | B.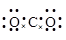 |
C.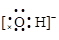 |
D.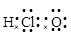 |
下列物质中,既含有离子键,又含有共价键的是
| A.NaOH | B.H2O | C.Na2S | D.CaCl2 |
下列叙述正确的是
| A.非金属原子间以共价键结合的物质都是共价化合物 |
| B.含有共价键的化合物都是共价化合物 |
| C.凡是能电离出离子的化合物都是离子化合物 |
| D.凡是含有离子键的化合物都是离子化合物 |
下列说法正确的是
| A.第二周期元素从C到F,非金属性逐渐减弱 |
| B.第三周期元素从Na到Cl,原子半径逐渐增大 |
| C.HF、HCl、HBr、HI的热稳定性依次逐渐减弱 |
| D.LiOH、NaOH、KOH的碱性依次逐渐减弱 |
X+的结构示意图如右图所示,则X元素在周期表中的位置

| A.第三周期0族 | B.第四周期第ⅠA族 |
| C.第三周期第ⅠA族 | D.第三周期第ⅦA族 |