在标准状况下,将aLNH3完全溶于水得到VmL氨水,溶液的密度为ρg·cm-3,溶质的质量分数为ω,溶质的物质的量浓度为cmol/L。下列叙述中正确的是
①ω= ②c=
②c=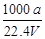
③上述溶液中再加入VmL水后,所得溶液的质量分数大于0.5ω
④上述溶液中再加入1.5VmL同浓度稀盐酸,充分反应后溶液中离子浓度大小关系为:
c(Cl-)>c(NH4+)>c(H+)>c(OH-)
| A.①④ | B.②③ | C.①③ | D.②④ |
X、Y、Z、W有如图所示转化关系,且ΔH=ΔH1+ΔH2,则X、Y可能是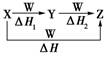
①C、CO ②S、SO2 ③AlCl3、Al(OH)3 ④Na2CO3、NaHCO3⑤Fe、FeCl2
A.①②③④⑤ B.②④⑤
C.①③④ D.①②③
下列属于新能源的是
①天然气 ②煤 ③海洋能 ④石油 ⑤太阳能 ⑥生物质能⑦风能 ⑧氢能
| A.①②③④ | B.③⑤⑥⑦⑧ |
| C.①③⑤⑥⑦⑧ | D.③④⑤⑥⑦⑧ |
下列叙述中不正确的是
| A.电解池的阳极上发生氧化反应,阴极上发生还原反应 |
| B.原电池的正极上发生氧化反应,负极上发生还原反应 |
| C.电镀时,电镀池里的阳极材料发生氧化反应 |
| D.用原电池做电源进行电解时,电子从原电池负极流向电解池阴极 |
选用下列试剂和电极:稀H2SO4、Fe2(SO4)3溶液、Fe、Cu、Zn,组成如图所示的原电池装置(只有两个电极):观察到电流计G的指针均明显偏转,则其可能的组合共有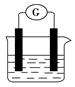
| A.3种 | B.4种 | C.5种 | D.6种 |
已知热化学方程式:2H2(g)+O2(g)===2H2O(g) ΔH1=-483.6 kJ/mol,则对于热化学方程式:2H2O(l)===2H2(g)+O2(g) ΔH2,下列说法正确的是
| A.热化学方程式中化学计量数表示分子个数 |
| B.该反应的ΔH2=+483.6 kJ/mol |
| C.|ΔH2|<|ΔH1| |
| D.|ΔH2|>|ΔH1| |