向恒温、恒容(2L)的密闭容器中充入2mol X和一定量的Y,发生反应:2X(g) +Y(g)  2Z(g) ΔH =" -" Q(Q =197.74kJ/mol),4min后达到平衡,这时c(X) =0.2 mol·L-1,且X与Y的转化率相等。下列说法中不正确的是
2Z(g) ΔH =" -" Q(Q =197.74kJ/mol),4min后达到平衡,这时c(X) =0.2 mol·L-1,且X与Y的转化率相等。下列说法中不正确的是
| A.达到平衡时,再充入1molX,该反应的Q变大 |
| B.用Z表示4min内的反应速率为0.2mol/(L·min) |
| C.再向容器中充入1molZ,达到新平衡,v(X) ∶v(Y) =2∶1 |
| D.该反应在高温下不一定能自发进行 |
下列关于元素周期表和元素周期律的说法错误的是( )
| A.Li、Na、K元素的原子核外电子层数随着核电荷数的增加而增多 |
| B.第二周期元素从Li到F,非金属性逐渐减弱 |
| C.Na和Cs属于第ⅠA族元素,Cs失电子能力比Na的强 |
| D.O与S为同主族元素,且O比S的非金属性强 |
苯环结构中不存在单双键的交替结构,不能作为证据的事实是 ( )
A.苯在一定条件下既能发生取代反应,又能发生加成反应 B苯环上碳碳键的键长相等
C.苯的邻二溴代物 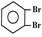 无同分异构体D.苯不能使酸性高锰酸钾溶液褪色
无同分异构体D.苯不能使酸性高锰酸钾溶液褪色
工业制取硫酸有一步重要反应是SO2在400~5000C下的催化氧化,2SO2+O2  2SO3 ,如果反应在密闭容器中进行,下述有关说法中错误的是 ()
2SO3 ,如果反应在密闭容器中进行,下述有关说法中错误的是 ()
| A.使用催化剂是为了加快反应速率,提高生产效率 |
| B.在上述条件下,SO2不可能100%的转化为SO3 |
| C.若加入的为18O2,则一段时间后SO2、O2 、SO3中均含有18O |
| D.达到平衡时,SO2的浓度与SO3的浓度相等 |
碱金属钫(Fr)具有放射性,它是碱金属元素中最重的元素,下列对其性质的预言中,正确的是()
| A.它能跟水反应,由于反应剧烈而发生爆炸 |
| B.它的氢氧化物化学式为FrOH,是一种弱碱 |
| C.钫在空气中燃烧时,只生成化学式为Fr2O的氧化物 |
| D.在碱金属元素中它的原子半径最小 |
从海水可获得的在常温下为液体的单质是()
| A.Mg | B.K | C.Br2 | D.I2 |