食用明胶是水溶性蛋白质混合物,具有很高的营养价值,溶于水形成胶体。而工业明胶中往往含有超标的重金属Cr,从而对人体造成伤害。
(1)已知Fe(CrO2)2中铬元素是+3价,则其中铁元素是___________价。
(2)化学上可将某些盐写成氧化物的形式,如Na2SiO3可写成Na2O·SiO2,则Fe(CrO2)2可写成________。
(3)明胶的水溶液和K2SO4溶液共同具备的性质是___________。
a.都不稳定,密封放置沉淀
b.两者均会发生丁达尔效应
c.分散质微粒可通过滤纸
(4)已知胶体的分散质微粒不能透过半透膜,但小分子或离子能透过半透膜。现将10 mL明胶的水溶液与5 mL NaBr溶液混合后装入半透膜袋内,将此半透膜袋浸入盛蒸馏水的烧杯中。若要求只检验一种离子, 就能证明Na+、Br-透过半透膜,写出检验该离子的实验方法:______________________
(5)铬的化合价除了+3和+6价外,还有0,+2,+4和+5价等。现有24 mL浓度为0.05 mol·L-1的Na2SO3溶液恰好与20 mL浓度为0.02 mol·L-1的Na2Cr2O7溶液完全反应,则元素Cr在还原产物中的化合价为____________价。
(本题16分)钼酸钠晶体(Na2MoO4·2H2O)是无公害型冷却水系统的金属缓蚀剂,由钼精矿(主要成分是MoS2,含少量PbS等)制备钼酸钠晶体的部分流程如下: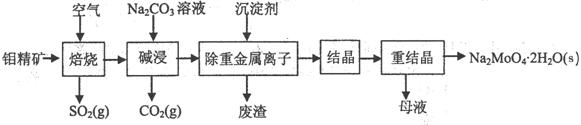 (1)焙烧的过程中采用的是“逆流焙烧”的措施,则该措施的优点是:①_______________
(1)焙烧的过程中采用的是“逆流焙烧”的措施,则该措施的优点是:①_______________
②____________________________
(2)写出焙烧时生成MoO3的化学方程式为:______________________________________
(3)写出“碱浸”反应的离子方程式:
(4)重结晶得到的母液可以在下次重结晶时重复使用,但达到一定次数后必须净化处理,原因是 。
(5)下图是碳钢在3种不同介质中的腐蚀速率实验结果: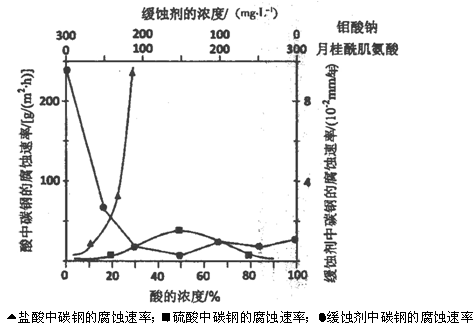
①碳钢在盐酸和硫酸中腐蚀速率随酸的浓度变化有明显差异,其原因可能是 ________________。
②空气中钼酸盐对碳钢的缓蚀原理是在钢铁表面形成FeMoO4—Fe2O3保护膜。
密闭式循环冷却水系统中的碳钢管道缓蚀,除需加入钼酸盐外还需加入NaNO2。则NaNO2的作用是 _________________________________________。
③若缓释剂钼酸钠—月桂酸肌氨酸总浓度为300mg·L-1,则缓蚀效果最好时钼酸钠的物质的量浓度为
(6)锂和二硫化钼形成的二次电池的总反应为:xLi + nMoS2 Lix(MoS2)n。则电池放电时的正极反应式是:___________________________________。
Lix(MoS2)n。则电池放电时的正极反应式是:___________________________________。
(本题16分)
(1)为了减轻汽车尾气造成的大气污染,人们开始探索利用NO和CO在一定条件下转化为两种无毒气体E和F的方法(已知该反应△H<0). 在2 L密闭容器中加入一定量NO和CO,当温度分别在T1和T2时,测得各物质平衡时物质的量如下表:
 物质 物质T/℃ n/mol |
NO |
CO |
E |
F |
| 初始 |
0.100 |
0.100 |
0 |
0 |
| T1 |
0.020 |
0.020 |
0.080 |
0.040 |
| T2 |
0.010 |
0.010 |
0.090 |
0.045 |
①请结合上表数据,写出NO与CO反应的化学方程式.
②根据表中数据判断,温度T1和T2的关系是(填序号)__________。
A.T1>T2 B.T1<T2 C.T1=T2 D.无法比较
(2)已知:4NH3(g) + 3O2(g) = 2N2(g) + 6H2O(g); ΔH= - 1266.8 kJ/mol
N2(g) + O2(g) =" 2NO(g)" ; ΔH =" +" 180.5kJ/mol,
则氨催化氧化的热化学方程式为________________________________________。
(3)500℃下,在A、B两个容器中均发生合成氨的反应。隔板Ⅰ固定不动,活塞Ⅱ可自由移动。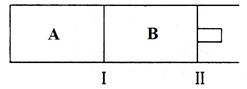
当合成氨在容器B中达平衡时,测得其中含有1.0molN2,0.4molH2,0.4molNH3,此时容积为2.0L。则此条件下的平衡常数为___________;保持温度和压强不变,向此容器中通入0.36molN2,平衡将___________(填“正向”、“逆向”或“不”)移动。
(4)在相同的密闭容器中,用方法Ⅱ和方法Ⅲ制得的两种Cu2O分别进行催化分解水的实验: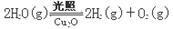 ΔH >0
ΔH >0
水蒸气的浓度(mol·L-1)随时间t (min)变化如下表:
| 序号 |
温度 |
0 |
10 |
20 |
30 |
40 |
50 |
| ① |
T1 |
0.050 |
0.0492 |
0.0486 |
0.0482 |
0.0480 |
0.0480 |
| ② |
T1 |
0.050 |
0.0488 |
0.0484 |
0.0480 |
0.0480 |
0.0480 |
| ③ |
T2 |
0.10 |
0.094 |
0.090 |
0.090 |
0.090 |
0.090 |
可以判断:实验①的前20min的平均反应速率ν(O2)=;催化剂的催化效率:实验①实验②(填“>”、“<”)。
(5)最新研究发现,用隔膜电解法可以处理高浓度乙醛废水。原理:使用惰性电极和乙醛-Na2SO4溶液为电解质溶液,乙醛分别在阴、阳极转化为乙醇和乙酸。
总反应为:2CH3CHO+H2O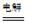 CH3CH2OH+CH3COOH。
CH3CH2OH+CH3COOH。
过程中,两极除分别生成乙酸和乙醇外,均产生无色气体,阳极电极反应分别为:
4OH--4e-═O2↑+2H2O;。
(本题16分)已知反应①:
化合物Ⅱ可由化合物Ⅲ合成:
(1)化合物Ⅰ的分子式为。反应①的反应类型为 。
(2)过量的化合物Ⅰ与HOOCCH2CH2COOH发生酯化反应,反应的化学方程式为
____________________(注明条件)。
(3)化合物Ⅲ的结构简式为。化合物Ⅲ可与NaOH乙醇溶液共热,反应的化学方程式 _________________________________。
(4)化合物Ⅰ在一定条件下氧化生成化合物Ⅳ(分子式为C9H10O),化合物Ⅳ的一种同分异构体Ⅴ能发生银镜反应,Ⅴ的核磁共振氢谱除苯环峰外还有三组峰,峰面积之比为为2:2:1,Ⅴ的结构简式为 ______________________________
(5)一定条件下,1分子  与1分子
与1分子 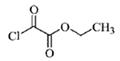 也可以发生类似反
也可以发生类似反
应①的反应,有机化合物结构简式为______________________
(本题16分)无水AlCl3可用作有机合成的催化剂、食品膨松剂等。工业制备无水AlCl3的流程如下: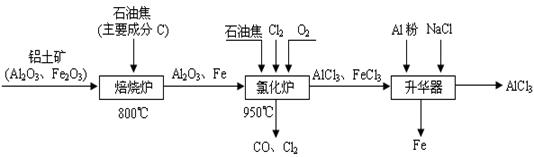
(1)氯化炉中通入O2的目的是 _________。
(2)氯化炉中Al2O3、C12和C反应的化学方程式是____________________________。
(3)氯化炉中导出的气体,通常用亚硫酸钠溶液来吸收,请写出用Na2SO3溶液处理尾气时发生反应的离子方程式___________________________________________________。
(4)在升华器中加入铝粉的目的是_________________________________________。
(5)用氯化铝晶体(AlCl3·6H2O)在HCl气中加热也能进行无水氯化铝的制备。但若实验条件控制不当,最终得到的物质是碱式氯化铝[化学式为Al2(OH)nCl(6-n)],且质量是原氯化铝晶体(AlCl3·6H2O)的40%,则可推算n的值为。
(6)镀铝电解池中,金属铝为阳极,熔融盐电镀液中铝元素主要以AlCl4-形式存在,则阳极的电极反应式为___________________________________。
(本题16分)工业上利用CO2和H2在一定条件下反应合成甲醇。
(1)已知在常温常压下:
① 2CH3OH(l) + 3O2(g) = 2CO2(g) + 4H2O(g) ΔH=-1275.6 kJ/mol
②2CO (g)+ O2(g) = 2CO2(g)ΔH=-566.0 kJ/mol
③H2O(g) = H2O(l)ΔH=-44.0 kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:____________ ________
(2)甲醇脱氢可制取甲醛CH3OH(g) HCHO(g)+H2(g),甲醇的平衡转化率随温度变化曲线如下图所示。回答下列问题:
HCHO(g)+H2(g),甲醇的平衡转化率随温度变化曲线如下图所示。回答下列问题:
①脱氢反应的△H_____0,600K时,Y点甲醇的υ(正) _____υ(逆)(填“>”或“<”)
②从Y点到X点可采取的措施是_______________________________________________。
③有同学计算得到在t1K时,该反应的平衡常数为8.1mol·L-1。你认为正确吗?请说明理由__________________________________________________________________________。
(3)纳米级Cu2O由于具有优良的催化性能而受到关注。在相同的密闭容器中,使用不同方法制得的Cu2O(Ⅰ)和(Ⅱ)分别进行催化CH3-OH的脱氢实验:
CH3OH(g) HCHO(g)+H2(g)
HCHO(g)+H2(g)
CH3OH的浓度(mol·L-1)随时间t (min)变化如下表:
| 序号 |
温度 |
0 |
10 |
20 |
30 |
40 |
50 |
| ① |
T1 |
0.050 |
0.0492 |
0.0486 |
0.0482 |
0.0480 |
0.0480 |
| ② |
T1 |
0.050 |
0.0488 |
0.0484 |
0.0480 |
0.0480 |
0.0480 |
| ③ |
T2 |
0.10 |
0.094 |
0.090 |
0.090 |
0.090 |
0.090 |
可以判断:实验①的前20min的平均反应速率ν(H2)=;实验温度T1T2(填“>”、“<”);催化剂的催化效率:实验①实验②(填“>”、“<”)。
(4)用CH3-OH、空气、KOH溶液和石墨电极可构成燃料电池。则该电池的负极反应式为:
___________________________________________。