一定条件下,下列反应中水蒸气含量随反应时间的变化趋势符合题图的是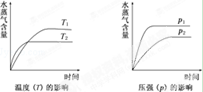
| A.CO2(g)+2NH3(g)⇌CO(NH2)2(s)+H2O(g);△H<0 |
| B.CO2(g)+H2(g)⇌CO(g)+H2O(g);△H>0 |
| C.CH3CH20H(g)⇌CH2=CH2(g)+H2O(g);△H>0 |
| D.2C6H5CH2CH3(g)+O2(g)⇌2C6H5CH=CH2(g)+2H2O(g);△H<0 |
除去下列物质中所含杂质(括号中的物质)所选用的试剂和装置均正确的是
Ⅰ.试剂:①KMnO4/H+②NaOH溶液 ③饱和Na2CO3溶液④H2O ⑤Na ⑥Br2/H2O ⑦Br2/CCl4
Ⅱ.装置: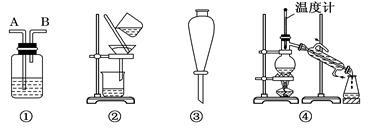
| 选项 |
物质 |
试剂 |
装置 |
| A |
C2H6(C2H4) |
⑥ |
① |
| B |
苯(苯酚) |
① |
③ |
| C |
CH3COOC2H5(CH3COOH) |
③ |
② |
| D |
甲苯(二甲苯) |
① |
③ |
由甲酸甲酯、葡萄糖、乙醛、丙酸四种物质组成的混合物,已知其中氧元素的质量分数为37%,则氢元素的质量分数为
| A.54% | B.63% | C.9% | D.12% |
下列说法中不正确的是
| A.乙烯与苯都能使溴水褪色,但褪色原理不同 |
| B.1 mol乙烯与Cl2完全加成,然后与Cl2发生取代反应,共消耗氯气5mol |
| C.溴水遇到乙醛溶液出现褪色现象,是因为它们发生了氧化反应 |
D.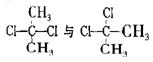 互为同分异构体 互为同分异构体 |
进行一氯取代反应后,只能生成三种沸点不同的产物的烷烃是
| A.(CH3)2CHCH2CH2CH3 | B.(CH3CH2)2CHCH3 |
| C.(CH3)2CHCH(CH3)2 | D.(CH3)3CCH2CH3 |
关于 的说法正确的是
的说法正确的是
| A.所有碳原子有可能都在同一平面上 | B.最多可能有9个碳原子在同一平面上 |
| C.只可能有3个碳原子在同一直线上 | D.有7个碳原子可能在同一条直线上 |