配制一定物质量浓度的NaOH溶液时,下列事实中一定会使配成溶液的实际浓度的实际浓度比所要求的浓度偏小的是
| A.用部分潮解的NaOH固体配制溶液 |
| B.将NaOH固体溶解后立即注入容量瓶配制溶液 |
| C.容量瓶中原来就有少量蒸馏水 |
| D.定容观察时俯视液面 |
锌铜原电池装置如图所示,其中阳离子交换膜只允许阳离子和水分子通过,下列有关叙述正确的是
| A.铜电极上发生氧化反应 |
| B.电池工作一段时间后,甲池的c(SO)减小 |
| C.电池工作一段时间后,乙池溶液的总质量增加 |
| D.阴阳离子分别通过交换膜向负极和正极移动, |
保持溶液中电荷平衡
常温下,用0.100 0 mol·L-1 NaOH溶液滴定20.00 mL 0.100 0 mol·L-1 CH3COOH溶液滴定曲线如图所示。下列说法正确的是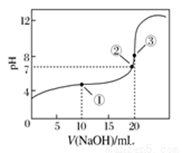
| A.点①所示溶液中:c(Na+)=c(CH3COOH)+c(CH3COO-) |
| B.点②所示溶液中:c(Na+)=c(CH3COOH)+c(CH3COO-) |
| C.点③所示溶液中:c(Na+)>c(OH-)>c(CH3COO-)>c(H+) |
| D.滴定过程中可能出现: |
c(CH3COOH)>c(CH3COO-)>c(H+)>c(Na+)>c(OH-)
下列叙述正确的是
| A.NaHCO3溶液中存在: c(OH-) =c(H+)+c(H2CO3) |
| B.某二元弱酸强碱盐NaHA溶液中存在:c(Na+)+c(H+)=c(A2-)+c(HA-)+c(OH-) |
| C.CH3COONa和NaCl混合溶液中存在:c(Na+)=c(CH3COO-)+c(Cl-) |
| D.常温下,10mL 0.02mol·L-1 HCl溶液与10mL 0.01mol·L-1 Ba(OH)2溶液充分混合,若混合后溶液的体积为20mL,则溶液的pH=7 |
有关电化学知识的描述正确的是
| A.CaO+H2O===Ca(OH)2ΔH<0,故可把该反应设计成原电池 |
| B.某原电池反应为Cu+2AgNO3==Cu(NO3)2+2Ag,装置盐桥中为装有含琼胶的KCl饱和 溶液 |
| C.原电池的两极一定是由活动性不同的两种金属组成 |
| D.理论上说,任何能自发进行的氧化还原反应都可设计成原电池 |
下列说法正确的是
| A.NaHCO3是强电解质,BaCO3是弱电解质 |
| B.c(H+)=1×10-7mol·L-1的溶液一定呈中性 |
| C.将硫酸铝和氯化铝溶液分别加热蒸干后灼烧,得到的固体都是氧化铝 |
| D.温度一定时,当溶液中Ag+和Cl-浓度的乘积等于Ksp值时,此溶液为AgCl的饱和溶液 |