将一定质量的镁、铜组成的混合物加入到稀硝酸中,金属完全溶解(假设反应中还原产物全部是NO)。向反应后的溶液中加入3mol/LNaOH溶液至沉淀完全,测得生成沉淀的质量比原合金的质量增加7.65g,则下列叙述中正确的是
| A.当生成沉淀达到最大量时,消耗NaOH溶液的体积为150mL |
| B.当金属全部溶解时收集到NO气体的体积为0.336L(标准状况下) |
| C.当金属全部溶解时,参加反应的硝酸的物质的量一定是0.6mol |
| D.参加反应的金属的总质量一定是9.9g |
下列说法正确的是
| A.HF、HCl、HBr、HI的热稳定性依次减弱,沸点却依次升高 |
| B.熔融状态下能导电的化合物一定含离子键;金属与非金属元素形成的化合物一定是离子化合物 |
| C.NCl3分子中所有的原子均为8电子稳定结构 |
| D.NaHSO4晶体中阴、阳离子的个数是1:2且熔化时破坏的是离子键和共价键 |
下列关于氯水的叙述,不正确的是
| A.新制氯水中只含有Cl2和H2O分子 |
| B.加入AgNO3溶液有白色沉淀产生 |
| C.光照氯水有气泡逸出,久置的氯水,酸性增强 |
| D.饱和氯水与石灰石的反应是制取较浓HClO溶液的重要方法 |
下列反应的离子方程式书写正确的是
| A.向NH4HSO4稀溶液中逐滴加入Ba(OH)2稀溶液至刚好沉淀完全:Ba2+ + 2OH- + NH4+ + H+ + SO42- = BaSO4↓+ NH3·H2O + H2O |
| B.碳酸钙溶于醋酸:CaCO3 + 2H+ =Ca2+ + CO2↑+ H2O |
| C.向硅酸钠溶液中通入过量的CO2:SiO32-+ CO2 + H2O= H2SiO3↓+ CO32- |
| D.澄清石灰水与过量小苏打溶液混合:Ca2+ + OH- + HCO3-="=" CaCO3↓+H2O |
下表所列各组物质中,物质之间通过一步反应就能实现如图所示转化的是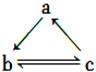
| a |
b |
c |
|
| A |
Al |
AlCl3 |
Al(OH)3 |
| B |
HNO3 |
NO |
NO2 |
| C |
S |
SO3 |
H2SO4 |
| D |
Si |
SiO2 |
H2SiO3 |
可以验证硫元素的非金属性比氯元素弱的事实是
①H2S水溶液是弱酸,HCl水溶液是强酸②向氢硫酸溶液中滴入氯水有单质硫生成③硫、氯气分别与铜和铁反应,其产物是FeS、Cu2S、FeCl3、CuCl2④高氯酸(HClO4)的酸性比硫酸强
| A.②③④ | B.②④ | C.①②④ | D.①②③④ |