新材料和新能源的开发和利用越来越成为科学家研究的方向。
典例一、用电弧法合成的储氢纳米常伴有大量的碳纳米顺粒(杂质),这种颗粒可用氧化气化法提纯,其反应式为:
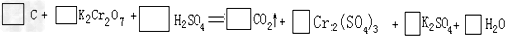
(1)完成配平上述反应的化学方程式:
(2)反应的氧化剂是__________,氧化产物是____________
(3)H2SO4在上述反应中表现出来的性质是________(填选项编号)(多选倒扣分)
| A.酸性 | B.氧化性 | C.吸水性 | D.脱水性 |
(4)上述反应中若产生0.2molCO2气体,则转移电子的物质的量是________mol
典例二、溴及其化合物广泛应用于医药、农药、纤维、塑料组燃剂等,回答下列问题:
(1)海水提溴过程中,向浓缩的海水中通入 ,将其中的Br-氧化,再用空气吹出溴;然后用碳酸钠溶液吸收溴,溴歧化为Br-和BrO3-,其离子方程式为 。
(2)溴与氯能以共价键结合形成BrCl。BrCl分子中, 显正电性。BrCl与水发生反应的化学方程式为 。
温度对化学平衡的影响是通过改变_____________________实现的;催化剂对反应速率的影响是通过减小______________实现的。
本题有A、B两小题,分别对应于“物质结构与性质”和“实验化学”两个选修模块的内容。请选定其中一题,并在相应的答题区域内作答。若两题都做,则按A题评分。
A.(1)偏钛酸钡的热稳定性好,介电常数高,在小型变压器、话筒和扩音器中都有应用。试回答下列问题:
①Ti元素在元素周期表中的位置是;其基态原子的
电子排布式为。
②偏钛酸钡晶体中晶胞的结构示意图如右图,它的化学式是;晶体内与每个“Ti”紧邻的氧原子数为个。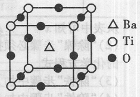
(2)氰气[(CN)2]无色、剧毒、有苦杏仁味,和卤素单质性质相似。已知氰分子中键与键之间的夹角为180。,并有对称性,其结构式为,与CN一互为等电子体的 单质的分子式为。
单质的分子式为。
B.某课题小组同学测量液态奶含氮量的实验过程如下: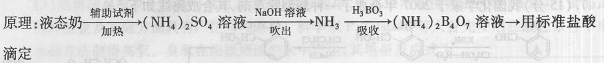
步骤:
①在烧杯中加入10.00mL液 态奶和辅助试剂,加热
态奶和辅助试剂,加热
充分反应;
②将反应液转移到大试管中;
③按右图装置用水蒸气将NH3吹出,并用H3BO3溶液吸收(加热装置未画出);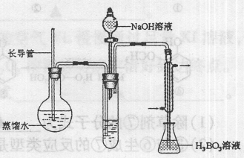
④取下锥形瓶,滴加指示剂,用0.1000mol·L-1盐酸
标准液滴定;
⑤重复测定数次,再用10.00mL蒸馏水代替液态奶进
行上述操作。
数据记录如下:
回答下列问题:
(1)滴定时(NH4)2B4O7重新转化为H3BO3,反应的离子方程式为。
(2)步骤③的实验装置中需要加热的仪器是(填仪器名称),长导管的作用是 。
。
(3)不做空白对照实验对实验结果有何影响(填“无影响”,或“偏高”,或“偏低”)。
(4)计算10.00mL液态奶中的含氮量应代人计算的盐酸体积是mL,该 液态奶的含氮量mg·mL-1。
液态奶的含氮量mg·mL-1。
二甲醚(CH3OCH。)和甲醇(CH3OH)被称为21世纪的新型燃料,具有清洁、高效等优良的性能。以CH4和H2O为原料制备二甲醚和甲醇的工业流程如下: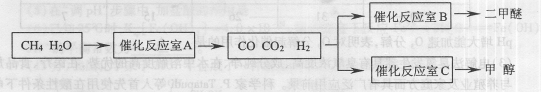
(1)催化反应室B中CO 与H2合成二甲醚的化学方程式为.
与H2合成二甲醚的化学方程式为.
(2)催化反应室A中发生的反应为:
CH4(g)+H2O(g)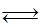 CO(g)+3H2(g)……(I)、CO(g)+H2O(g)
CO(g)+3H2(g)……(I)、CO(g)+H2O(g)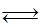 CO2(g)+H2(g)……(Ⅱ)催化反应室C中发生的反应为:
CO2(g)+H2(g)……(Ⅱ)催化反应室C中发生的反应为:
CO(g)+2H2(g)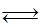 CH3OH(g)……(Ⅲ)、CO2(g)+3H2(g)
CH3OH(g)……(Ⅲ)、CO2(g)+3H2(g) CH3OH(g)+H2O(g)……(Ⅳ)
CH3OH(g)+H2O(g)……(Ⅳ)
①已知:原子利用率= ×100%,试求反应(Ⅳ)的原子利用率为。
×100%,试求反应(Ⅳ)的原子利用率为。
②反应(Ⅳ)的△S 0(填“>”、“=”或“<”)。
③在压强为5MPa,体积为VL的反应室c中,amol CO与20mol H2在催化剂作用下发生反应(Ⅲ)生成甲醇,CO的转化率与温度的关系如右图。则该反应的△H0(填“>”、“=”或“<”)。300℃时该反应的平衡常数K= (用含字母的代数式表示)。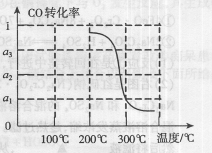
(3)我国某科研所提供一种碱性“直接二甲醚燃料电池”。
该燃料电池负极的电极反应式为:
CH3OCH3一12e一+16OH一=2CO2-3+11H2O。有人提出了一种利用氯碱工业产品治理含二氧化硫(体积分数为x)废气的方法如下:
①将含SO2的废气通人电解饱和食盐水所得溶液中,得NaHSO3溶液;
②将电解饱和食盐水所得气体反应后制得盐酸;
③将盐酸加入NaHSO3溶液中得SO2气体回 收。
收。
用上述碱性“直接二甲醚燃料电池”电解食盐水来处理标准状况下VL的废气,计算消耗二甲醚的质量。
重铬酸钠(Na2Cr2O7)主要用于印染、制革、医药、电镀等。工业上以铬铁矿(主要成分FeO·Cr2O3)、碳酸钠、氧气和硫酸为原料生产重铬酸钠(Na2Cr2O7·2H2O)的主要反应如下:
①4FeO·Cr2O3+8Na2CO3+7O2 8Na2CrO4+2Fe2O3+8CO2
8Na2CrO4+2Fe2O3+8CO2
②2Na2Cr04+H2S04.-----~Na2S04+Na2Cr207+H20
(1)反应①是在回转窑中进行,反应时需不断搅拌,
其目的是 。
。
(2)右图是红矾钠(Na2Cr2O7·2H2O)和Na2SO4的溶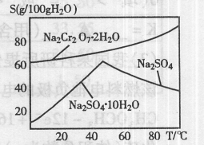
解度曲线。从Na2Cr2O7和Na2SO4的混合溶液中提取Na2Cr2O7,
晶体的操作:先将混合溶液蒸发浓缩,趁热过滤。趁热过滤的目的是;然后将滤液,从而析出红矾钠。
(3)Na2Cr2O7与KCl或K2SO4进行复分解反应可制取K2Cr2O7,现
用Na2Cr2O7与KCl来制备K2Cr2O7,简述操作步骤(有关物质的溶
解度见右表):。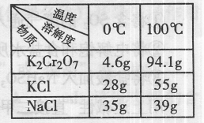
(4)重铬酸钾可用于铁矿石中铁的含量测定,实验步骤如下:
步骤1:将mg铁矿石加浓盐酸加热溶 解
解
步骤2:加入SnCl2溶液将Fe3+还原至黄色消失
步骤3:将所得溶液冷却,加入HgC2溶液,将过量的Sn2+氧化
为Sn4+
步骤4:加人15mL硫酸和磷酸的混合酸及5滴O.2%二苯胺磺酸钠指示剂
步骤5:立即用cmol·L。重铬酸钾溶液滴定至溶液呈稳定紫色,即为终点,消耗重铬酸钾溶液VmL
①写出SnCl2还原Fe3+的离子方程式。
②如省去步骤③,则所测定的铁的含量(填“偏高”、“偏低”或“无影响”)。
③步骤5使用的玻璃仪器有
臭氧可用于净化空气,饮用水消毒,处理工业废物和作为漂白剂。
(1)臭氧几乎可与除铂、金、铱、氟以外的所有单质反应。如6Ag(s)+Os(g)=3Ag2O(s);
△H= 一235.8kJ·mol-1,已知2Ag2O(s)=4Ag(s)+O2(g);△H=+62.2kJ·mol-1,则O3转化为O2的热化学方程式为。
(2)臭氧在水中易分解,臭氧的浓度减少一半所需的时间如下图所示。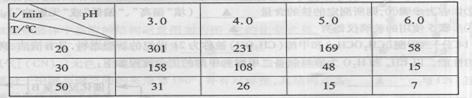
pH增大能加速O3分解,表明对O3分解起催化作用的是。
(3)电解法臭氧发生器具有臭氧浓度高、成分纯净、在水中溶解度高的优势,在医疗、食品加工与养殖业及家庭方面具有广泛应用前景。科学家P.Tatapudi等人首先使用在酸性条件下电解水的方法制得臭氧。臭氧在阳极周围的水中产生,其电极反应式为;阴极附近的氧气则生成过氧化氢,其电极反应式为。
(4)为测定大气中臭氧(03)含量,将0℃、1.01 × 105Pa的空气VL慢慢通过足量KI溶液,使臭氧完全反应;然后将所得溶液用amL cmol·L。的Na2S2O2溶液进行滴定恰好到达终点。
①O3与Ⅺ溶液反应生成两种单质,则反应的化学方程式。
②空气中臭氧的体积分数为。
(已知:2Na2S2+12=Na2S406+2NaI)