2004年美国圣路易斯大学研制了一种新型的乙醇电池,它用磺酸类质子溶剂,在200oC左右时供电,乙醇电池比甲醇电池效率高出32倍且更安全。电池总反应为:C2H5OH +3O2 ==2CO2 +3H2O,电池示意如图,下列说法不正确的是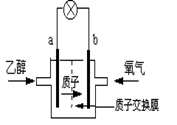
| A.a极为电池的负极 |
| B.电池工作时电流由b极沿导线经灯泡再到a极 |
| C.电池工作时,1mol乙醇被还原时就有6mol电子转移 |
| D.电池正极的电极反应为:4H+ + O2 + 4e— →2H2O |
除去乙烷气体中混有的乙烯,最好的方法( )
| A.加入氢气与乙烯反应 | B.点燃 |
| C.通入适量溴水 | D.通过KMnO4溶液 |
某烃分子中有一个环状结构和两个双键,它的分子式可能是( )
| A.C4H6 | B.C7H8 |
| C.C5H6 | D.C10H6 |
下列方程式书写正确的是
A.KHC03的水解: |
B.KHC03溶液与Al2(SO4)3溶液混合: |
C.将过量铁粉加入到稀硝酸中;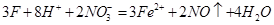 |
D.碳酸电离: |
下列溶液中有关物质的量浓度关系或计算正确的是
A.pH相等的NaOH、CH3COONa和NaHC03三种溶液,则有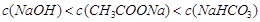 |
B.已知25℃时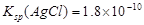 ,则在0.1mol·L-1AlCl3溶液中,Ag+的物质的量浓度最大可达到 ,则在0.1mol·L-1AlCl3溶液中,Ag+的物质的量浓度最大可达到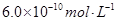 |
C.25℃时,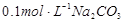 溶液中水电离出来的c(OH-)大于 溶液中水电离出来的c(OH-)大于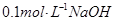 溶液中,水电离出来的c(OH-) 溶液中,水电离出来的c(OH-) |
D.室温下,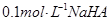 溶液的pH=4,则 溶液的pH=4,则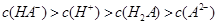 |
铜板上铁铆钉若较长时间地浸泡在海水中会生锈甚至腐烂,其腐蚀原理如右图所示。下列有关此过程的说法不正确的是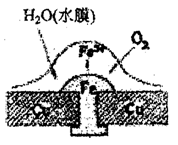
A.正极上的主要电极反应式为; |
| B.此过程中铜并未被腐蚀 |
| C.电子从Cu流向Fe |
D.此过程中还可能涉及到反应: |