化学反应N2+3H2 2NH3的能量变化下图所示,该反应的热化学方程式是
2NH3的能量变化下图所示,该反应的热化学方程式是
A.N2(g)+3H2(g) 2NH3(1);△H=2(a-b-c)kJ·mol-1 2NH3(1);△H=2(a-b-c)kJ·mol-1 |
B.N2(g)+3H2(g) 2NH3(g);△H=2(b-a)kJ·mol-1 2NH3(g);△H=2(b-a)kJ·mol-1 |
C.1/2N2(g)+ 3/2H2(g) NH3(1);△H=(b+c-a)kJ·mol-1 NH3(1);△H=(b+c-a)kJ·mol-1 |
D.1/2N2(g)+3/2H2(g) NH3(g);△H=(a+b)kJ·mol-1 NH3(g);△H=(a+b)kJ·mol-1 |
取一定质量的均匀固体混合物Cu、Cu2O和 CuO,将其分成两等份,取其中一份用足量的氢气还原,测得反应后固体质量减少6.40g,另一份中加入500mL稀硝酸,固体恰好完全溶解,且同时收集到标准状况下NO气体4.48L,则所用硝酸的物质的量浓度为
| A.2.8mol·L-1 | B.3.6mol·L-1 | C.3.2mol·L-1 | D.无法判断 |
将一定量Mg、Al合金溶于1 mol·L-1的HCl溶液中,进而向所得溶液中滴加1 mol·L-1的NaOH溶液,产生沉淀的物质的量(n)与滴加的NaOH溶液(mL)体积的关系如图所示。下列分析的结论中正确的是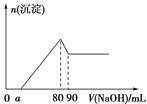
| A.无法给出实验中产生H2的物质的量 |
| B.欲给出a的取值范围尚缺少一个条件 |
C.无法认定Mg、Al合金中 的最大值 的最大值 |
| D.溶解“一定量Mg、Al合金”的HCl溶液的体积为90 mL |
某溶液中可能含有下列6种离子中的某几种:Cl-、SO42-、CO32-、NH4+、Na+、K+。为确认溶液组成进行如下实验:
(1)取200mL上述溶液,加入足量BaCl2溶液,反应后将沉淀过滤、洗涤、干燥,得沉淀4.30g,向沉淀中加入过量的盐酸,有2.33g沉淀不溶。
(2)向(1)的滤液中加入足量的NaOH溶液,加热,产生能使湿润红色石蕊试纸变蓝的气体1.12L(已换算成标准状况,假定产生的气体全部逸出)。由此可以得出关于原溶液组成的正确结论是
| A.一定存在SO42-、CO32-、NH4+,可能存在Cl-、Na+、K+ |
| B.一定存在SO42-、CO32-、NH4+、Cl-,一定不存在Na+、K+ |
| C.c(CO32-)=0.01mol·L-1,c(NH4+)>c(SO42-) |
| D.如果上述6种离子都存在,则c(Cl-)>c(SO42-) |
为提纯下列物质(括号内为杂质),选用的除杂试剂和分离方法都正确的是
| 选项 |
物质 |
除杂试剂 |
分离方法 |
| A |
二氧化硅(碳酸钙) |
氢氧化钠溶液 |
过滤 |
| B |
硫酸铜溶液(硫酸铁) |
加入过量铜粉 |
过滤 |
| C |
乙醇(乙酸) |
生石灰 |
蒸馏 |
| D |
SO2(CO2) |
碳酸钠溶液 |
洗气 |
下表中,对陈述Ⅰ、Ⅱ的正确性及两者间是否具有因果关系的判断都正确的是
| 选项 |
陈述Ⅰ |
陈述Ⅱ |
判断 |
| A |
碳酸钠、碳酸氢钠能用澄清石灰水鉴别 |
Na2CO3能与澄清石灰水反应生成白色沉淀,而NaHCO3不能 |
Ⅰ对, Ⅱ对, 有 |
| B |
向Na2O2的水溶液中滴入酚酞变红色 |
Na2O2与水反应生成氢氧化钠 |
Ⅰ对, Ⅱ错, 无 |
| C |
金属钠具有强还原性 |
高压钠灯发出透雾性强的黄光 |
Ⅰ对, Ⅱ对, 有 |
| D |
酚酞溶液在碳酸钠溶液中的颜色比在同浓度同温度的碳酸氢钠溶液中深 |
CO32-水解程度大于HCO3- |
Ⅰ对, Ⅱ对, 有 |