已知铅蓄电池的工作原理为Pb+PbO2+2H2SO4 2PbSO4+2H2O,现用如图装置进行电解(电解液足量),测得当 铅蓄电池中转移0.4 mol电子时铁电极的质量减少11.2 g。请回答 下列问题。
2PbSO4+2H2O,现用如图装置进行电解(电解液足量),测得当 铅蓄电池中转移0.4 mol电子时铁电极的质量减少11.2 g。请回答 下列问题。
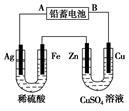
(1)A是铅蓄电池的 极,铅蓄电池正极反应式为 ,放电过程中电解液的密度 (填“减小”、“增大”或“不变”)。
(2)Ag电极的电极反应式是 ,该电极的电极产物共 g。
(3)Cu电极的电极反应式是 ,CuSO4溶液的浓度 (填“减小”、“增大”或“不变”)
(4)如图表示电解进行过程中某个量(纵坐标x)随时间的变化曲线,则x表示 。
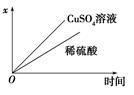
a.各U形管中产生的气体的体积
b.各U形管中阳极质量的减少量
c.各U形管中阴极质量的增加
高温焙烧含硫废渣会产生SO2废气,为了回收利用SO2,研究人员研制了利用低品位软锰矿浆(主要成分是MnO2)吸收SO2,并制备硫酸锰晶体的生产流程,其流程示意图如下:
已知,浸出液的pH<2,其中的金属离子主要是Mr12+,还含有少量的Fe2+、Al3+等其他金属离子。有关金属离子形成氢氧化物沉淀时的pH见下表:
| 离子 |
开始沉淀时的pH |
完全沉淀时的pH |
| Fe2+ |
7.6 |
9.7 |
| Fe3+ |
2.7 |
3.7 |
| Al3+ |
3.8 |
4.7 |
| Mn2+ |
8.3 |
9.8 |
请回答下列问题:
(1)高温焙烧:在实验室宜选择的主要仪器是。
(2)写出氧化过程中主要反应的离子方程式:。
(3)在氧化后的液体中加入石灰浆,并调节溶液pH,pH应调节的范围是。
(4)滤渣的主要成分有__________。
(5)工业生产中为了确定需要向浸出液中加入多少MnO2粉,可准确量取l0.00 mL浸出液用0.02mol/L酸性KMnO4溶液滴定,判断滴定终点的方法是____;若达滴定终点共消耗l0.00 mL酸性KMnO4溶液,请计算浸出液中Fe2+浓度是。
(6)操作a的具体过程________。
A、B、C、D、E是原子序数依次增大的短周期主族元素。A元素可形成多种同素异形体,其中一种是自然界最硬的物质;B的原子半径在短周期主族元素中最大;C原子核外电子占据7个不同的原子轨道;D的单质在常温常压下是淡黄色固体。
(1)E在元素周期表中的位置;B的基态原子核外电子排布式为。
(2)A、D、E中电负性最大的是(填元素符号);B、C两元素第一电离能较大的是(填元素符号)。
(3)A和D两元素非金属性较强的是(填元素符号),写出能证明该结论的一个事实依据。
(4)化合物AD2分子中共有个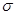 键和___个
键和___个 键,AD2分子的空间构型是。
键,AD2分子的空间构型是。
(5)C与E形成的化合物在常温下为白色固体,熔点为190℃,沸点为182.7℃,在177.8℃升华,推测此化合物为晶体。工业上制取上述无水化合物方法如下:C的氧化物与A、E的单质在高温条件下反应,已知每消耗12kgA的单质,过程中转移2×l03mol e-,写出相应反应的化学方程式:。
有机物A、B、C、D、E、F均只含C、H、O三种元素,在一定条件下有以下转化关系:
有以下信息可供参考:
I.A分子中共有24个原子,其蒸汽密度是相同状况下氢气的95倍。
II.B分子中含有苯环,苯环上有两个取代基,且处于对位,能发生银镜反应,与FeCl3溶液相遇不显紫色。
III.A、B相对分子质量相差54。
IV.反应②③类型相同,均有O2参与。根据推断,回答下列问题:
(1)A的分子式;E中的含氧官能团的名称是。
(2)1H核磁共振谱图中,B分子中有种峰。
(3)反应②的反应类型是。
(4)加热条件下D与新制Cu(OH)2悬浊液反应的化学方程式;
反应④的化学方程式。
(5)写出符合下列要求的B的同分异构体的结构简式(除B外)。
①苯环上的一溴代物只有两种结构;②可发生银镜反应;③可与NaOH溶液反应。
电浮选凝聚法是工业上采用的一种污水处理方法:保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3沉淀。Fe(OH)3有吸附性,可吸附污物而沉积下来,具有净化水的作用。阴极产生的气泡把污水中悬浮物带到水面形成浮渣层,刮去(或撇掉)浮渣层,即起到了浮选净化的作用。某科研小组用电浮选凝聚法处理污水,设计装置示意图,如图所示。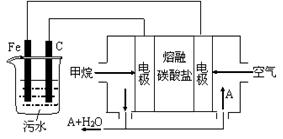
(1)实验时若污水中离子浓度较小,导电能力较差,产生气泡速率缓慢,无法使悬浮物形成浮渣。此时,应向污水中加入适量的__________(填序号)。
a.H2SO4
b.BaSO4
c.Na2SO4
d.NaOH
e.CH3CH2OH
(2)电解池阳极发生两个电极反应,反应式分别是:①__________;②4OH——4e—= O2↑+2H2O;
(3)电极反应①和②的生成物发生反应得到Fe(OH)3的离子方程式是________________;
(4)该燃料电池是以熔融碳酸盐为电解质,CH4为燃料,空气为氧化剂。已知负极的电极反应是CH4 + 4CO32— — 8e—="=" 5CO2 + 2H2O。
①正极的电极反应是___________________;
②为了使该电池长时间稳定运行,电池的电解质组成应保持稳定,电池工作时必须有部分A参加循环(见上图)。A物质的化学式是__________;
(5)实验过程中,若阴极产生44.8 L(标况)气体,则燃料电池消耗CH4(标况)_____L。
固体AlCl3和FeCl3混合物中含有少量FeCl2和Al2(SO4)3,某同学设计并进行实验对该混合物进行分离,以得到纯净的AlCl3和FeCl3,图甲是该同学设计并进行的实验: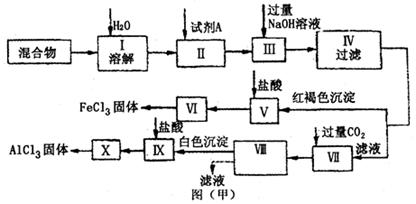
(1)操作Ⅱ中加入的试剂A,最好选用_____(填序号)。
A.酸性KMnO4溶液B.硝酸C.H2O2D.浓硫酸
(2)操作V的离子方程式为_______________;操作Ⅶ的离子方程式为___________________。
(3)图乙是操作Ⅵ制取无水FeCl3和操作X制取无水AlCl3的部分装置(铁架台、加热装置等略去)。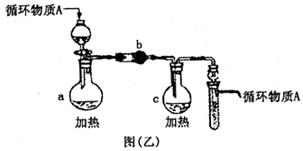
①图乙中,装置a由____________、圆底烧瓶、双孔塞和导管组成。
②循环物质A是______________________。
③装置b中填充的物质可以是_______________________(填编号)。
A.碱石灰B.无水氯化钙C.浓硫酸D.五氧化二磷
(4)你认为该同学的实验最后_____________(填“能”或“不能”)得到纯净的AlCl3和FeCl3。若不能,请你完善该同学的实验步骤设计:________________(用文字叙述。如能,则不需回答)。