共海洋植物如海带、海藻中含有丰富的碘元素,主要以碘化物形式存在。有一化学课外小组用海带为原料制取少量碘单质,他们将海带灼烧成灰,用水浸泡一段时间(以让碘化物充分溶解在水中),得到海带灰悬浊液,然后按以下实验流程提取单质碘:
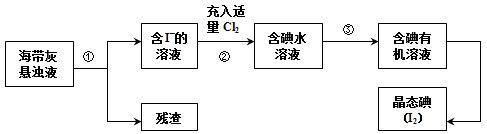
(1)灼烧海带时需要用到的实验仪器是__________________(从下列仪器中选出所需的仪器,用标号字母填写在空白处)。
A 烧杯 B 坩埚
C 表面皿 D 坩埚钳
E 酒精灯 F 泥三角 G 三脚架
(2)指出提取碘的过程中有关的实验操作名称:①___________,③___________。
(3)操作③中所用的有机试剂可以是___________(只填一种),简述选择其理由______________。
(4)从含有碘的有机溶剂中获取碘,常用水浴加热蒸馏的方法,其优点是_______,最后晶态碘在__________ 里聚集。
右图为探讨苯和溴的反应改进的实验装置图。其中A为具支试管改制成的反应容器,在其下端开了一个小孔,并塞好石棉绒,实验时先加少量铁粉于石棉绒上。填写下列空白:
(1) 向反应容器A中逐滴加入溴和苯的混合液,几秒钟内发生反应,写出A中所发生反应的化学方程式、;
(2) 反应开始后观察D和E两试管,看到的现象为、,说明苯和溴发生了反应(填反应类型);
(3) B中的NaOH溶液作用是吸收反应生成的溴苯中溶解的溴单质,则A中铁粉的作用是,试管C中苯的作用是;
(4) 在上述整套装置中,具有防倒吸的仪器除D外还有(填字母)。
(10分) 某学生为验证苯的沸点(80.1℃)比水低,设计了如图1所示的实验装置:(某些固定装置已略去)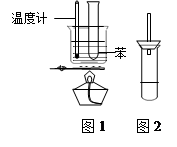
(1) 该实验中能够说明苯的沸点比水低的实验现象是;
(2) 使用该实验装置的一个明显的缺点就是难以控制苯蒸气的大量外逸,有人在盛苯的试管口装上一个带有直玻璃导管的塞子(如右图2所示) ,改进后装置的直玻璃导管能防止苯蒸气的大量外逸的原因是;
(3) 该实验的加热方法是____,其优点是;
(4)苯与浓硝酸、浓硫酸的混合物在100~110℃时的主要产物的结构简式为:。
为探究亚硫酸钠的热稳定性,某研究性学习小组将无水亚硫酸钠隔绝空气加热,并利用受热后的固体试样和下图所示的实验装置进行实验。请回答下列有关问题:
(1)查阅资料:无水亚硫酸钠隔绝空气受热到600℃才开始分解,且分解产物只有硫化钠和另外一种固体。如果加热温度低于600℃,向所得冷却后固体试样中缓缓滴加稀盐酸至足量,在滴加稀盐酸的整个过程中 的物质的量浓度变化趋势为;
的物质的量浓度变化趋势为;
(2)如果加热温度为700℃,向所得冷却后固体试样中缓缓滴加稀盐酸至足量,观察到烧瓶中出现淡黄色沉淀,且有大量气泡产生,则反应生成淡黄色沉淀的离子方程式为;此时在B、C两装置中可能观察到得现象为。
(3)在(2)中滴加足量盐酸后,烧瓶内除 外,还存在另一种浓度较大的阴离子(X)。为检验该阴离子(X),先取固体试样溶于水配成溶液,为了加速固体试样的溶解,可采取措施。以下是检验阴离子(X)的两种实验方案,你认为合理的方案是(填“甲”或“乙”),
外,还存在另一种浓度较大的阴离子(X)。为检验该阴离子(X),先取固体试样溶于水配成溶液,为了加速固体试样的溶解,可采取措施。以下是检验阴离子(X)的两种实验方案,你认为合理的方案是(填“甲”或“乙”),
请说明另一方案不合理的原因。方案甲:取少量试样溶液于试管中,先加稀 ,再加
,再加 溶液,有白色沉淀生成,证明该离子存在。
溶液,有白色沉淀生成,证明该离子存在。
方案乙:取少量试样溶液于试管中,先加稀HCl,再加 溶液,有白色沉淀生成,证明该离子存在。
溶液,有白色沉淀生成,证明该离子存在。
(4)写出 固体加热到600℃以上分解的化学方程式。
固体加热到600℃以上分解的化学方程式。
利用下列实验仪器:①铁架台(含铁圈、各种铁夹);②锥形瓶;③滴定管(酸式与碱式);④烧杯(若干个);⑤玻璃棒;⑥天平(含砝码);⑦滤纸;⑧量筒;⑨漏斗
试剂:Na2CO3固体;标准NaOH溶液;未知浓度盐酸;Na2CO3溶液;蒸馏水。
进行下列实验或操作:
(1)做酸碱中和滴定时,还缺少的试剂是:
(2)配制250mL 0.1mol•L-1某溶液时,还缺少的仪器是:
(3)过滤时,应选用上述仪器中的(填编号)
(10分)硫酸工业尾气中二氧化硫的含量超过0.05%(体积分数)时需经处理后才能排放。某校化学兴趣小组欲测定某硫酸工厂排放尾气中二氧化硫的含量,分别采用以下方案:
[甲方案]:如右图所示,图中气体流量计B用于准确测量通过的尾气体积。将尾气通入一定体积已知浓度的碘水中测定SO2的含量。当洗气瓶C中溶液蓝色消失时,立即关闭活塞A。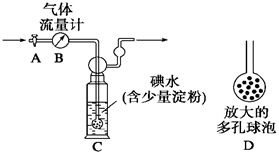
(1)洗气瓶C中导管末端连接一个多孔球泡D,可以提高实验的准确度,其理由是___________________________________。
(2)洗气瓶C中溶液蓝色消失后,没有及时关闭活塞A,测得的SO2含量____________(填“偏高”、“偏低”或“无影响”)。
[乙方案]:实验步骤如下面流程图所示:
(3)步骤①中过量H2O2的作用是
(4)写出步骤②中反应的化学方程式__________________________________________
(5)步骤②中Ba(OH)2是否足量的判断方法是__________________________________
______________________________________________________________________。
(6)通过的尾气体积为V L(已换算成标准状况)时,该尾气中二氧化硫的含量(体积分数)为_____________________________(用含有V、m的代数式表示)。