(10分)硫酸工业尾气中二氧化硫的含量超过0.05%(体积分数)时需经处理后才能排放。某校化学兴趣小组欲测定某硫酸工厂排放尾气中二氧化硫的含量,分别采用以下方案:
[甲方案]:如右图所示,图中气体流量计B用于准确测量通过的尾气体积。将尾气通入一定体积已知浓度的碘水中测定SO2的含量。当洗气瓶C中溶液蓝色消失时,立即关闭活塞A。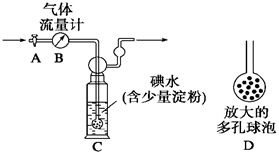
(1)洗气瓶C中导管末端连接一个多孔球泡D,可以提高实验的准确度,其理由是___________________________________。
(2)洗气瓶C中溶液蓝色消失后,没有及时关闭活塞A,测得的SO2含量____________(填“偏高”、“偏低”或“无影响”)。
[乙方案]:实验步骤如下面流程图所示:
(3)步骤①中过量H2O2的作用是
(4)写出步骤②中反应的化学方程式__________________________________________
(5)步骤②中Ba(OH)2是否足量的判断方法是__________________________________
______________________________________________________________________。
(6)通过的尾气体积为V L(已换算成标准状况)时,该尾气中二氧化硫的含量(体积分数)为_____________________________(用含有V、m的代数式表示)。
(共12分)I.常压下乙醇的沸点为78.5℃,乙酸的沸点为118℃,以下是分离乙醇、乙酸的方案,请填空[(1)(3)是药品,(2)(4)是操作名称]
填空:(1) (3) (4)
|
II.(6分)下图装置是用燃烧法来确定有机物组成的常用装置,这种方法是在电炉加热时用纯氧氧化管内样品,根据产物的质量确定有机物的组成(已知:C中的氧化铜是确保有机物中的碳元素完全转化为二氧化碳;A中的反应为2H2O2 = 2H2O + O2↑)。

乙醇的沸点是78℃,能与水以任意比例混溶。乙醚的沸点为34.6℃,
难溶于水,在饱和Na2CO3溶液中几乎不溶,乙醚极易燃烧。实验室制乙醚的
反应原理是

(1) 图甲和乙是两套实验室制乙醚的装置,选装置最合适。
(2) 反应液中应加入沸石,其作用是。
(3) 反应中温度计的位置是。
(4) 用装置乙制得的乙醚中可能含有大量的乙醇,除去乙醇的简易方法是。
(5) 如果温度太高将会发生另一有机反应,此反应方程式为
。
铝镁合金已成为轮船制造、化工生产等行业的重要材料。研究性学习小组的三位同学,为测定某含镁3%-5%的铝镁合金(不含其它元素)中镁的质量分数,设计下列三种不同实验方案进行探究。填写下列空白(可能用到的相对原子质量:Al-27)
[探究一] 实验方案: 。
。
实验步骤:
(1)称取5.4g铝镁合金粉末样品,投入VmL 2.0mol·L-1NaOH溶液中,充分反应。NaOH溶液的体积V≥。
(2)过滤、洗涤、干燥、称量固体。该步骤中若未洗涤固体,测得镁的质量分数将
(“偏高”或“偏低”)
[探究二] 实验方案: (实验装置如下图)
(实验装置如下图)
问题讨论:
为使测定结果尽可能精确,实验中应注意的问题是(写出可能的一点):
。
[探究三] 实验方案:称量m g铝镁合金粉末.放在如右图所示装置的惰性电热板上,通电使其充分灼烧。
问题讨论:欲计算Mg的质量分数,该实验中还需测定的数据是。
[实验拓展] 请你另设计一个实验方案,测定该铝镁合金中镁的质量分数(书写形式可以模仿探究一、二实验方案)。
某研究性学习小组在网上收集到如下信息:Fe(NO3)3溶液可以蚀刻银,制作美丽的银饰。他们对蚀刻银的原因进行了如下探究:
[实验]制备银镜,并与Fe(NO3)3溶液反应,发现银镜溶解。
(1)下列有关制备银镜过程的说法正确的是。
a.边振荡盛有2%的AgNO3溶液的试管,边滴入2%的氨水。至最初的沉淀恰好溶解为止
b.将几滴银氨溶液滴入2 mL乙醛中
c.制备银镜时,用酒精灯的外焰给试管底部加热
d.银氨溶液具有较弱的氧化性
e.在银氨溶液配制过程中,溶液的pH增大
[提出假设]
假设1:Fe3+具有氧化性,能氧化Ag。
假设2:Fe(NO3)3溶液显酸性,在此酸性条件下NO3— 能氧化Ag。
[设计实验方案,验证假设]
(2)甲同学从上述实验的生成物中检验出F e3+,验证了假设1成立。请写出Fe3+氧化Ag的离子方程式:。
e3+,验证了假设1成立。请写出Fe3+氧化Ag的离子方程式:。
(3)乙同学设计实验验证假设2,请帮他完成下表中内容(提示: NO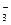 在不同条件下的还原产物较复杂,有时难以观察到气体产生)。
在不同条件下的还原产物较复杂,有时难以观察到气体产生)。
实验步骤(不 要求写具体操作过程) 要求写具体操作过程) |
预期现象和结论 |
| ① ② …… |
若银镜消失,假设2成立。 若银镜不消失,假设2不成立。 |
[思考与交流]
(4)甲同学验证了假设1成立,若乙同学验证了假设2也成立。则丙同学由此得出结论:Fe(NO3)3溶液中的Fe3+和NO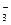 都氧化了Ag。
都氧化了Ag。
你是否同意丙同学的结论_____,并简述理由:(用离子方程式表示)。
某兴趣小组探究SO2气体还原Fe3+、I2,他们使用的药品和装置如下图所示:
FeCl3溶液含有淀粉的 碘水 NaOH溶液
碘水 NaOH溶液
A B C
(1)SO2气体还原Fe3+的产物是(填离子符号),参加反应的SO2和Fe3+的物质的量之比是。
(2)下列实验方案适用于在实验室制取所需SO2的是(填序号)。
A.Na2SO3溶液与HNO3 B.Na2SO3固体与浓硫酸
C.固体硫在纯氧中燃烧 D.铜与热浓H2SO4
(3)装置C的作用是。(4)若要从A中所得溶液提取晶体,必须进行的实验操作步骤:蒸发、冷却结晶、过滤、自然干燥,在这一系列操作中没有用到的仪器有(填序号)。
A.蒸发皿 B.石棉网 C.漏斗 D.烧杯 E.玻璃棒 F.坩埚
(5)在上述装置中通入过量的SO2,为了验证A中SO2与Fe3+发生了氧化还原反应,他们取A中的溶液,分成三份,并设计了如下实验:
方案①:往第一份试液中加入KMnO4溶液,紫红色褪去。
方案②:往第二份试液加入KSCN溶液,不变红,再加入新制的氯水,溶液变红。
方案③:往第三份试液加入用稀盐酸酸化的BaCl2,产生白色沉淀。
上述方案不合理的是,原因是。
(6)能表明I-的还原性弱于SO2的现象是。