Ⅰ.聚四氟乙烯在耐热性和化学稳定性上都超过了其他塑料,号称“塑料之王”,可用于制造飞机、导弹的无油轴承,密封填料,人造血管,滑雪板,不粘锅等。其合成路线如下图所示:
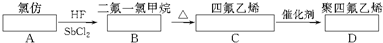
写出下列化学反应方程式。
B→C:_______ _________________
C→D:_____________ _
Ⅱ.实验室制取乙烯气体时,常因温度过高混合液迅速变黑,并产生具有刺激性气味的气体SO2。某同学设计了如图所示的实验装置以确证反应制得的混合气体中含有乙烯和SO2。
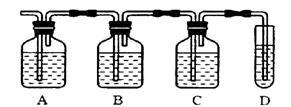
可供选择的试剂:①酸性高锰酸钾溶液、②稀硝酸、③浓硫酸、④品红溶液、⑤石蕊试液、⑥NaOH溶液。
(1)各装置中所盛放的试剂分别是(填写序号):A_________,B_________,C_________,D_________。
(2)装置B的作用是__________________,装置C的作用是___________________。
(3)能说明混合气体中含SO2的实验现象是_________ ______,确证混合气体中有乙烯的实验现象是____ __。
已知H2O2、KMnO4、NaClO、K2Cr2O7均具有强氧化性,将溶液中的Cu2+、Fe2+、Fe3+沉淀为氢氧化物,需溶液的pH分别为6.4、6.4、3.7。现有含FeClx杂质的氯化铜晶体(CuCl2·2H2O),为制取纯净的CuCl2·2H2O,首先将其制成水溶液,然后按图示步骤进行提纯:

请回答下列问题:
(1)本实验最适合的氧化剂X是__________。(选填下面的序号)
| A.K2Cr2O7 | B.NaClO | C.H2O2 | D.KMnO4 |
(2)物质Y是________。
(3)本实验用加碱沉淀的目的是否能达到?________________。原因是________________。
(4)除去Fe3+的化学方程式为________________________________。
(5)加氧化剂的目的为________________________。
(6)最后能不能直接蒸发结晶得到CuCl2·2H2O晶体?________________。原因是________。
某二元酸(化学式用H2A表示)在水中的电离方程式是:
H2A====H++HA- HA- H++A2-
H++A2-
试完成下列问题:
(1)Na2A溶液显_______(填“酸性”“中性”或“碱性”)。
理由是___________________________________________(用离子方程式表示)。
(2)在0.1 mol·L-1的Na2A溶液中,下列粒子浓度关系式正确的是_________。
A.c(A2-)+c(HA-)+c(H2A)="0.1" mol·L-1
B.c(OH-)=c(H+)+c(HA-)
C.c(Na+)+c(H+)=c(OH-)+c(HA-)+2c(A2-)
D.c(Na+)=2c(A2-)+2c(HA-)
(3)已知0.1 mol·L-1NaHA溶液的pH=2,则0.1 mol·L-1 H2A溶液中氢离子的物质的量浓度可能是0.11 mol·L-1_________ (填“<”“>”或“=”),理由是____________________________________。
(4)0.1 mol·L-1 NaHA溶液中各种离子浓度由大到小的顺序是:__________________________。
已知某浓度的硫酸在水中的电离方程式:
H2SO4====H++HSO-4,
 H++
H++ 。
。
(1)Na2SO4溶液显________(填“酸性”“碱性”或“中性”),理由是(用离子方程式表示)_________。
(2)在25 ℃时0.1 mol·L-1的NaHSO4溶液中c( )="0.029" mol ·L-1,则25 ℃时,0.1 mol·L-1 H2SO4溶液中c(
)="0.029" mol ·L-1,则25 ℃时,0.1 mol·L-1 H2SO4溶液中c( )________(填“大于”,“小于”或“等于”)0.029 mol ·L-1,理由是__________。
)________(填“大于”,“小于”或“等于”)0.029 mol ·L-1,理由是__________。
(3)在0.1 mol ·L-1 Na2SO4溶液中,下列粒子浓度关系正确的是()
A.c(Na+)+c(H+)=c(OH-)+c(HSO-4)+2c( ) ) |
B.2c (Na+)=c( )+c(HSO-4) )+c(HSO-4) |
C.c(Na+)>c( )>c (H+)>c (OH-) )>c (H+)>c (OH-) |
D.c( )+c(HSO-4)="0.1" mol·L-1 )+c(HSO-4)="0.1" mol·L-1 |
(1)加热蒸干Al2(SO4)3(aq),得到的固体物质是______________________(写化学式)。
(2)加热蒸干NaHCO3(aq),得到的固体物质是______________________(写化学式)。
(3)加热蒸干Na2SO3(aq),得到的固体物质是______________________(写化学式)。
(6分) “神舟”7号宇宙飞船是靠长征Ⅱ(F)型运载火箭发射升空的。该火箭所用的燃料是偏二甲肼〔(CH3)2N—NH2〕,氧化剂是N2O4,产物是氮气、二氧化碳和水。
(1)火箭点火瞬间,逸出的红棕色气体是_______,产生该气体的化学反应方程式为
_________。
(2)偏二甲肼在N2O4中燃烧的化学方程式为_________________________,当有1 mol偏二甲肼燃烧时,转移电子的物质的量为___________。