通过NO传感器可监测NO的含量,其工作原理如图所示。下列说法错误的是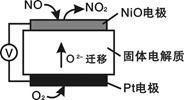
| A.该装置实现化学能向电能的转化 |
| B.该电池的总反应为2NO + O2 = 2NO2 |
| C.NiO电极的电极反应式: NO + O2- - 2e—= NO2 |
| D.当有2.24L的O2参与反应时,转移了0.4mole— |
下图是部分短周期元素原子半径与原子序数的关系图。则下列说法正确的是
| A.简单离子的半径大小比较:Y>X>Z |
| B.气态氢化物稳定性:X>R |
| C.R最高价氧化物对应水化物中既有离子键又有共价键 |
| D.Z单质能从M的盐溶液中置换出单质M |
常温下,下列有关溶液的叙述正确的是
| A.将pH=1的醋酸和pH=13的Na OH溶液混合后,若c(CH3COO-)=c(Na+),则溶液显中性 |
| B.在Na2SO3溶液中:c(Na+) = 2c(SO32- ) + c(HSO3-) + c(OH- ) |
| C.pH=6的CH3COOH溶液和pH=6的NH4Cl溶液,由水电离出的c(H+)均为1×10-8mol·L-1 |
| D.在饱和Na2CO3溶液中:2c(Na+) = c(CO32-) + c(HCO3-) + c(H2CO3) |
对下列装置的叙述错误的是
| A.X如果是硫酸铜,a和b分别连接直流电源正、负极,一段时间后铁片质量增加 |
| B.X如果是氯化钠,则a和b连接时,该装置可模拟生铁在食盐水中被腐蚀的过程 |
| C.X如果是硫酸铁,则不论a和b是否用导线连接,铁片均发生氧化反应 |
| D.X如果是氢氧化钠,将碳电极改为铝电极,a和b用导线连接,此时构成原电池铁作负极 |
下列陈述Ⅰ、Ⅱ正确并且有因果关系的是
| 选项 |
陈述Ⅰ |
陈述Ⅱ |
| A |
浓H2SO4有吸水性 |
浓H2SO4可用于干燥NH3 |
| B |
二氧化硅不与任何酸反应 |
可用石英制造耐酸容器 |
| C |
铝具有强还原性 |
可以通过铝热反应冶炼某些高熔点金属 |
| D |
铜的金属活泼性比铁的弱 |
在海轮外壳上装若干铜块以减缓其腐蚀 |
设NA为阿伏伽德罗常数的数值,下列说法正确的是
| A.常温常压下,22.4L氧气与金属钠完全反应,转移的电子数一定是4NA |
| B.常温常压下,1.7gH2O2中含有电子数为0.9NA |
| C.1L 0.2 mol·L-1FeCl3溶液中,含有Fe3+粒子数为0.2 NA |
| D.标准状况下,0.1mol 甲苯所含C-C键数为0.6NA |