金属镍有广泛的用途。粗镍中含有少量Fe、Zn、Cu、Pt等杂质,可用电解法制备高纯度的镍。电解时,下列有关叙述正确的是(已知氧化性Fe2+<Ni2+<Cu2+)
| A.阳极发生还原反应,其电极反应式:Ni2+ + 2e— = Ni |
| B.电解过程中,阳极质量的减少与阴极质量的增加相等 |
| C.电解后,溶液中存在的金属阳离子只有Fe2+ 和Zn2+ |
| D.电解后,电解槽底部的阳极泥中只有Cu和Pt |
下列方案能够达到实验目的的是
| A.用浓溴水除去苯中的苯酚 |
| B.用新制Cu(OH)2悬浊液鉴别苯、乙醛、乙酸 |
| C.在加热条件下,用乙醇除去乙酸乙酯中的乙酸 |
| D.将溴乙烷和NaOH溶液混合加热后,再加入硝酸银溶液,检验溴元素 |
下列过程中不涉及氧化还原反应的是
| A.由植物油制备人造黄油 |
| B.用氯化铁溶液腐蚀印刷线路板 |
| C.用牺牲阳极的阴极保护法防止金属被腐蚀 |
| D.在蛋白质溶液中加入饱和硫酸铵溶液,析出白色固体 |
下列说法正确的是
| A.PM 2.5的产生与人类活动无关 |
| B.硅是现代光学及光纤制品的基本原料 |
| C.酒精可使蛋白质变性,故能消毒杀菌 |
| D.塑化剂是一种化工塑料软化剂,可以大量添加到婴幼儿玩具中 |
铅蓄电池是最常见的二次电池,其构造示意图如下。发生反应的化学方程式为:
Pb(s) + PbO2(s) + 2H2SO4(aq) 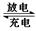 2PbSO4(s) + 2H2O(l)
2PbSO4(s) + 2H2O(l)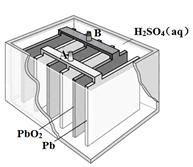
下列说法不正确的是
| A.放电时,正极反应为:PbO2(s) + 4H+(aq) + SO42-(aq) +2e- = PbSO4(s) + 2H2O(l) |
| B.充电时,应将外接直流电源的正极与铅蓄电池的接线柱A相接 |
| C.实验室用铅蓄电池做电源精炼粗铜时,应将粗铜与接线柱B相连接 |
| D.铅蓄电池做电源电解Na2SO4溶液时,当有2 mol O2产生时,消耗8 mol H2SO4 |
温度为T时,向2 L恒容密闭容器中充入1 mol PCl5,发生PCl5(g)  PCl3(g) + Cl2(g)反应。反应过程中c(Cl2) 随时间变化的曲线如下图所示,下列说法不正确的是
PCl3(g) + Cl2(g)反应。反应过程中c(Cl2) 随时间变化的曲线如下图所示,下列说法不正确的是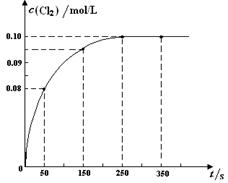
| A.反应在0 ~50 s 的平均速率v(Cl2) =1.6×10-3mol/(L·s) |
| B.该温度下,反应的平衡常数K = 0.025 |
| C.保持其他条件不变,升高温度,平衡时c(PCl3)=0.11mol/L,则该反应的ΔH <0 |
| D.反应达平衡后,再向容器中充入 1 mol PCl5,该温度下再达到平衡时,0.1 mol/L<c(Cl2)<0.2 mol/L |